
【题目】【选修5:有机化学基础】化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:

(1)E中的含氧官能团名称为 。
(2)B转化为C的反应类型是 。
(3)写出D与足量NaOH溶液完全反应的化学方程式 。
(4)1molE最多可与 molH2加成。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式 。
A.苯环上只有两个取代基,且除苯环外无其他环状结构
B.核磁共振氢谱只有4个峰
C.能与FeCl3溶液发生显色反应
(6)已知:酚羟基一般不易直接与羧酸酯化,甲苯可被酸性高锰酸钾溶液氧化为苯甲酸。试参照如下和成路线图示例写出以苯酚、甲苯为原料制取苯甲酸苯酚酯(![]() )的合成路线(无机原料任选)。合成路线流程图示例如下:
)的合成路线(无机原料任选)。合成路线流程图示例如下:![]()
【答案】(1)羟基、酯基 (2分,每个名称1分)
(2)酯化反应(取代反应)(1分)
(3)
(4)4 (2分)
(5) (4分,每写一个计2分)
(4分,每写一个计2分)
(6)
【解析】
试题分析:由合成流程可知,A为CH3CHO,B为邻羟基苯甲酸发生酯化反应生成C,C为 ,C与CH3COCl发生取代反应生成D,D中含-COOC-,能发生水解反应,D水解酸化后发送至酯化反应生成E;
,C与CH3COCl发生取代反应生成D,D中含-COOC-,能发生水解反应,D水解酸化后发送至酯化反应生成E;
(1)根据B的结构简式![]() 可知,B中含有的含氧官能团为羟基和羧基;
可知,B中含有的含氧官能团为羟基和羧基;
(2) 中的羧基与甲醇发生酯化反应生成C,则B转化为C的反应类型是酯化反应或取代反应;
中的羧基与甲醇发生酯化反应生成C,则B转化为C的反应类型是酯化反应或取代反应;
(3)D与足量NaOH溶液完全反应的化学方程式为![]() ;
;
(4)E中含苯环与C=C,均能与氢气发生加成反应,则1摩尔E最多可与4molH2加成;
(5)B为邻羟基苯甲酸,其同分异构体符合:
A.苯环上只有两个取代基,且除苯环外无其他环状结构;B.核磁共振氢谱只有4个峰,说明结果对称性比较强,通常两个取代基处于对位;C.能与FeCl3溶液发生显色反应,说明有酚羟基,则另一基团只能是甲酸酯基或甲酸基,所以符合条件的同分异构体为![]() 或
或![]() ;
;
(6)以苯、甲苯为原料制取苯甲酸苯酚酯,可以用苯与氯气发生取代生成氯苯,再水解得苯酚,用甲苯氧化得苯甲酸,苯甲酸与三氯化磷发生取代得苯甲酰氯,苯甲酰氯与苯酚发生取代反应生成苯甲酸苯酚酯,合成流程图为 。
。


科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组探究铜与浓硫酸的反应情况.甲.乙.丙三位同学进行了下列实验:取12.8g铜片和20ml.18mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余外,同时根据所学的知识认为还有较多的硫酸剩余.
(1)请写出铜跟浓硫酸反应的化学方程式: ,
试问:为什么较多的余酸不再与铜片继续反应?简述理由: .
可以证明有余酸的实验方案是 (填写字母,错选或多选扣分).
a.再加入铁粉 b.再滴入BaCl2溶液
c.再加入银 d.再滴入Na2CO3溶液
(2)甲学生设计求余酸浓度的实验方案是测定产生气体的量.其方法有多种,请问下列方案中不可行的是 (填写字母,错选或多选扣分).
a.将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量.
b.将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
c.用排水法测定其产生气体的体积(折算成标准状况).
d.用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况).
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量.在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤.洗涤.干燥、称量沉淀.请写出生成沉淀的离子方程式: .
(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是 .
(5)丙同学提出甲、乙两同学的实验方案设计的复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤.干燥.称量.若称得剩余铜片的质量为Wg,测得反应后溶液的体积为Vml,请计算剩余硫酸的物质的量浓度= mol/L(用含W.V的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。
锌片上发生的电极反应:__________________;银片上发生的电极反应:_________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况)___________L;
②通过导线的电量________C。(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g),下列叙述中不正确的是( )

A. Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有32.5g锌溶解时正极放出11.2 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
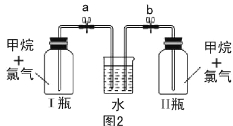
【题目】已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案:甲方案探究甲烷与氧化剂反应(如图1所示);乙方案探究甲烷与氯气反应的条件(如图2所示)。
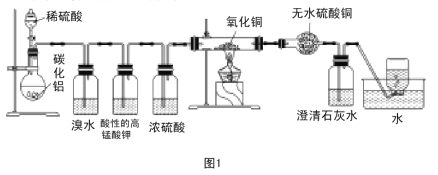
甲方案实验现象:溴水无颜色变化,无水硫酸铜变蓝色,澄清石灰水变浑浊。
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为 。
(2)写出甲方案实验中硬质试管里可能发生的化学方程式 (实验测得消耗甲烷与氧化铜物质的量之比2∶7)。
(3)实验甲中浓硫酸的作用是 ,集气瓶中收集到的气体 (填“能”或“不能”)直接排入空气中?
(4)下列对甲方案实验中的有关现象与结论的叙述都正确的是( )
A.酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应
B.硬质试管里黑色粉末变红色,说明氧化铜发生了氧化反应
C.硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(5)乙方案中烧杯里放入足量的水,打开弹簧夹a、b,一段时间后,观察到有水倒吸到I瓶中,但水并不能充满I瓶,请写出该实验现象所涉及的一个化学方程式 。除了上述现象外,该实验中还可能观察到的现象有 (填序号)。
A.I瓶中气体颜色变浅 B.I瓶中出现白雾
C.I瓶瓶内壁出现油状物质 D.II瓶中与I瓶现象相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;
FeO(s)+CO(g) ΔH1,平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2。
FeO(s)+H2(g) ΔH2,平衡常数为K2。
在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应 CO2(g) + H2(g)![]() CO(g) + H2O(g) ΔH,平衡常数K,则ΔH = (用ΔH1和ΔH2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) ΔH,平衡常数K,则ΔH = (用ΔH1和ΔH2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)![]() CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH > 0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH > 0,CO2的浓度与时间的关系如图所示:

① 该条件下反应的平衡常数为 ;
② 下列措施中能使平衡时![]() 增大的是 (填序号)
增大的是 (填序号)
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
③ 一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母)。
a.容器中压强不变
b.气体的密度不再改变
c.v正(CO2)=v逆(CO)
d.c(CO2)=c(CO)
e.容器内气体总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段c(B)未画出]。附图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3~t4阶段为使用催化剂。下列说法正确的是

A.该反应一定是放热反应
B.t4~t5阶段改变的条件为减小压强
C.B的起始物质的量为0.02mol
D.该反应的化学方程式为3A(g)+B(g)![]() 2C(g)
2C(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com