
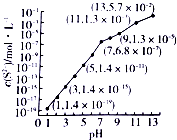
 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.分析 ①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH.
解答 解:①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,
故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)=$\frac{{K}_{sp}(MnS)}{c(M{n}^{2+})}$=$\frac{2.8×1{0}^{-13}}{0.020}$mol/L=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,
故答案为:5.
点评 本题考查了离子浓度大小比较、难溶物溶度积的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握难溶物溶度积的含义及应用方法是,试题培养了学生的分析能力及灵活应用能力.


 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油中 | |
| B. | 保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉 | |
| C. | 浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处 | |
| D. | 试剂瓶中的液溴可用水封存,防止溴挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③④ | C. | ②③④ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酯、A、B三种物质的分子中都含一种相同的式量大于45的原子团 | |
| B. | A的式量比B大14 | |
| C. | B的式量比A大16 | |
| D. | 该酯中一定不含双键等不饱和键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成33.6L N2(标准状况下) | B. | 被还原的N原子的物质的量为2mol | ||
| C. | 转移电子的物质的量为4mol | D. | 还原产物比氧化产物少0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的燃烧热为297.23 kJ•mol-1 | |
| B. | S升华是吸热过程 | |
| C. | S(g)+O2(g)═SO2(g)放出的热量小于297.23 kJ | |
| D. | 形成1 mol SO2的化学键释放的总能量大于断裂1 mol S(s)和1 mol O2(g)的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、H+、Fe2+、NO3- | B. | K+、NH4+、OH-、SO42- | ||
| C. | Na+、OH-、K+、HCO3- | D. | K+、H+、CH3COO-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com