
2- 3 |
2- 4 |
| 检验离子 | 所加试剂 | 实验现象 | 离子方程式 | ||
(1)CO
|
稀硝酸 | ||||
(2)SO
|
产生白色沉淀 | ||||
| (3)Cl- | 产生白色沉淀 |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| A、1:3:3 |
| B、3:1:2 |
| C、3:2:3 |
| D、1:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
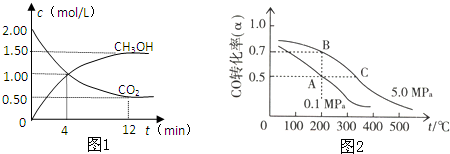
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增.已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题.
A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增.已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
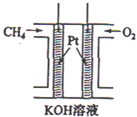 (1)金属铝是一种常见的金属,铝-海水-空气电池在航海中得到广泛的应用,写出该电池的正极反应方程式:
(1)金属铝是一种常见的金属,铝-海水-空气电池在航海中得到广泛的应用,写出该电池的正极反应方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com