
| A. | K2S | B. | SO2 | C. | H2S | D. | SO3 |
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:实验题
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 滴定次数 | 盐酸体积(ml) | NaOH溶液体积读数(ml) | |
| 滴定前 | 滴定后 | ||
| 20.00 | 0.00 | 16.30 | |
| 2 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下,1L pH=8的纯水中含OH-为10 -6mol | |
| B. | 电解精炼铜过程中,阳极质量的减少值与阴极质量的增加值一定相等 | |
| C. | 合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率 | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子数 | B. | 中子数 | C. | 质子数 | D. | 原子序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
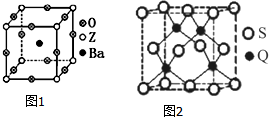 已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:| X元素是宇宙中最丰富的元素 |
| Y元素基态原子的核外p电子数比s电子数少1 |
| Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
| R元素在元素周期表的第十一列 |
| Q元素在周期表里与R元素在同一个分区 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com