
化学与社会、生活、技术和环境密切相关,下列说法正确的是( )
A.绿色化学的核心就是治理工业生产对环境产生的污染
B.铁、钙、碘都是人体必不可少的微量元素
C.苹果放在空气中久置变黄和纸张久置变黄原理相似
D.生活中常用的塑料制品及橡胶制品都为高分子材料
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2016届海南中学高三考前高考模拟十化学试卷(解析版) 题型:填空题
焦炭与CO、CO2、H2均是重要的化工原料,由CO2制备甲醇过程可能涉及的反应如下:
反应Ⅰ:CO2 (g)+3H2 (g)  CH3OH(g)+H2O(g) △H1 =-49.58kJ·mol -1
CH3OH(g)+H2O(g) △H1 =-49.58kJ·mol -1
反应Ⅱ:CO2 (g)+H2 (g)  CO(g)+H2O(g) △H2 =+41.19kJ·mol -1
CO(g)+H2O(g) △H2 =+41.19kJ·mol -1
反应Ⅲ:CO(g)+2H2(g)  CH3OH(g) △H3
CH3OH(g) △H3
回答下列问题:
(1)反应Ⅲ的△H3 = ,反应Ⅲ自发进行的条件是 (填“较低温”、“较高温”或“任何温度”)。
(2)将焦炭与水蒸气置于容积为2L的密闭容器中发生反应:C(s) +H2O(g)  CO(g)+H2(g),其中H2O、
CO(g)+H2(g),其中H2O、
CO的物质的量随时间的变化曲线如图所示。

①0~1min 内用H2表示该反应的速率为 ,第一个平衡时段的平衡常数是 。
②若反应进行到2min时,改变了温度,使曲线发生如图所示的变化,则温度变化为 (填“升温”或“降温”)。
③反应至5min时,若也只改变了某—个条件,使曲线发生如图所示的变化,该条件可能是下述中的 。
a.加入了C(s) b.加入了水蒸气
c.降低了温度 d.增大了压强
(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应Ⅰ、Ⅱ、Ⅲ),测得了不同温度下体系达到平衡时CO2的转化率(曲线a)及CH3OH 的产率(曲线b),如图所示,请回答问题:
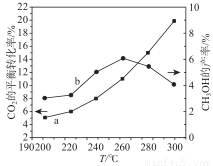
据图可知当温度高于260℃后,CO的浓度随着温度的升高而 (填“增大”、“减小”、“不变”或“无法判断”),其原因是 。
(4)若以CO、O2、K2CO3等构成的熔融盐电池为电源,用惰性电极电解200mL 饱和食盐水,则负极上的电极反应式为 ,当有2.8g燃料被消耗时,电解池中溶液的pH= (常温下,忽略溶液的体积变化,不考虑能量的其他损耗)。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:填空题
BPA的结构简式如右下图所示,常用来生产防碎塑料聚碳酸酯。
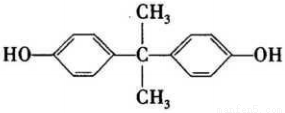
(1)该物质的分子式为___________,含氧官能团的名称是_________,属于____类。
(2)该物质最多_____个碳原子共面。
(3)充分燃烧0.1mol该有机物,消耗的O2在标准状况下的体积为_________。
(4)下列关于BPA的叙述中,不正确的是_______。
A.可以发生还原反应
B.遇FeCl3溶液紫色
C.1mol该有机物最多可与2molH2反应
D.可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第八次月考理综化学试卷(解析版) 题型:实验题
姜黄素的合成路线如图所示:

已知:①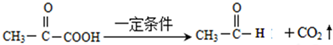
②
请回答下列问题:
(1)D中含有的官能团名称是__________,D→E的反应类型是__________。
(2)姜黄素的结构简式为__________。
(3)反应A→B的化学方程式为__________。
(4)D的催化氧化产物与B可以反应生成一种高分子化合物,其结构简式为__________。
(5)下列有关E的叙述不正确的是__________(填序号).
a.能发生氧化、加成、取代和缩聚反应
b.1molE与浓溴水反应最多消耗3mol的Br2
c.E能与FeCl3溶液发生显色反应
d.1molE最多能与3molNaOH发生反应
(6)G香兰醛(C8H8O3)的同分异构体中,符合下列条件的共有__________种,其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为__________
①属于酯类;②能发生银镜反应;③苯环上的一取代物只有2种;
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第八次月考理综化学试卷(解析版) 题型:选择题
下列有关电解质溶液的说法,不正确的是
A.pH 相同的NH4Cl,(NH4)2SO4溶液: c(NH4Cl) >c[(NH4)2SO4]
B.少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
C.等物质的量浓度的HA与NaA溶液等体积混合后,混合溶液一定呈酸性
D.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)=c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三5月高考模拟理综化学试卷(解析版) 题型:实验题
工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
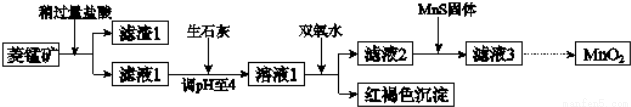
已知:1
生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
2:下表是三种难溶金属硫化物的溶度积常数(25℃)

回答下列问题:
(1)滤渣1为____________;
(2)向溶液1中加入双氧水时,反应的离子方程式是____________;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是____________;在CuS、MnS共存的悬浊液中,则c(Cu2+)/c(Mn2+)=____________。
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+□_____=□_____+□______+□______;
(5)将MnCl2转化为MnO2的另一种方法是电解法。
①生成MnO2的电极反应式是____________;
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2,检验Cl2的操作是____________。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三5月高考模拟理综化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
B.一定温度下,1L0.50mol/LNH4NO3溶液中含氮原子个数为NA
C.过氧化氢分解制得标准状况下1.12LO2,转移电子数目为0.2NA
D.28g分子式为CnH2n的链烃中含有的C-H键的数目为2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期中化学试卷(解析版) 题型:填空题
氧化铜矿用稀硫酸溶解后所得酸浸液(含Cu2+、H+、SO42-、Mg2+、A13+、Fe2+) 经下列流程可制得高纯度硫酸铜晶体:

已知:该实验条件下,各金属离子沉淀的pH如图所示。下列判断正确的是( )
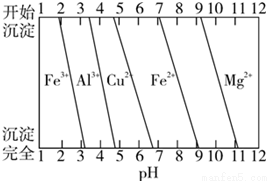
A.沉淀1的主要成分为Al(OH)3和Fe(OH)3
B.溶液2中所含金属阳离子只有Mg2+
C.将溶液3蒸干即得CuSO4·5H2O晶体
D.若不加入NaClO溶液,对制得硫酸铜晶体的纯度将无影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com