
分析 (1)依据m=CVM计算溶质的质量;
(2)根据配制一定物质的量浓度溶液一般步骤选择需要的仪器;
(3)溶解固体用玻璃棒搅拌加速固体溶解,移液时用玻璃棒引流;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制250mL 0.1mol/L的Na2CO3溶液,需要碳酸钠的质量m=0.25L×0.1mol/L×106g/mol=2.7g;
故答案为:2.7;
(2)配制250mL 0.1mol/L的Na2CO3溶液一般步骤:计算、称量、溶解、移液、洗涤、定容等,使用的仪器为:托盘天平(带砝码)、药匙、玻璃棒、烧杯、胶头滴管、250 mL容量瓶,所以还缺少:胶头滴管、500 mL容量瓶;
故答案为:250 mL容量瓶;胶头滴管;
(3)溶解固体用玻璃棒搅拌加速固体溶解,移液时用玻璃棒引流;
故答案为:搅拌;引流;
(4)A.转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度无影响,故A错误;
B.转移时,有少量溶液溅出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B正确;
C.定容时,仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故C正确;
D.定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故D错误;
故选:BC.
点评 本题考查了一定物质的量浓度溶液的配制过程中涉及到的仪器的选择和使用等问题,明确配制原理及操作步骤是解题关键,题目难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L CH3COOH溶液 | B. | 0.01mol/L HNO3溶液 | ||
| C. | pH=2的H2SO4溶液 | D. | pH=2的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
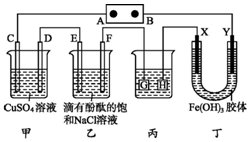 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿矾一FeSO4•7H2O | B. | 芒硝一Na2SO4•10H2O | ||
| C. | 明矾一Al(SO4)3•12H2O | D. | 胆矾一CuSO4•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
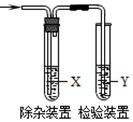 用如图所示装置检验乙烯时不需要除杂的是( )
用如图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | 水 | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | 水 | Br2的CCl4溶液 |
| C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
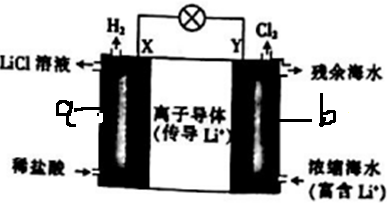
| A. | 电池工作时,Li+通过离子导体移向b区 | |
| B. | 电流由X极通过电路移向Y极 | |
| C. | 正极发生的反应为2H++2e-═H2↑ | |
| D. | Y极每生成1molCl2,a区得到2molLiCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②使用催化剂,△H2减小 | |
| C. | 反应③中反应物的总能量高于生成物的总能量 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,砷属于p区元素.
,砷属于p区元素.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com