


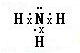
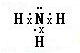
| ||
| ||
 .
. .
.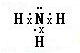 .
.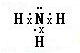 .
.
| ||
| ||


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
(16分)A、B、C、D、E为原子序www.ks5u.com数依次增大的五种短周期元素,已知A的一种核素的质量数为另一种核素质量数的2倍,A和C、B和E分别位于同一主族,且B、E的质子数之和是A、C质子数之和的2倍,C、D、E这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。试回答:![]()
(1)写出下列元素的符号:A_______、E______。![]()
(2)C、D、E三种元素离子半径由大到小的顺序是 _________(填相应的离子符号)。![]()
(3)由A、B两元素形成的原子个数比为1∶1化合物的电子式是_______。![]()
(4)C、D元素的最高价氧化物的水化物之间反应的离子方程式是:_________。![]()
(5)用多孔石墨电极电解滴有酚酞的C元素和氯元素形成的化合物的饱和溶液,接通电源一段时间后,_______极(填电极名称)附近出现红色,另一极的电极反应式为_______,可用___________检验该电极所得产物。![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com