
【题目】在重铬酸钾(K2 Cr2O7)水溶液中橙红色的Cr2O72-与黄色的CrO42-有以下平衡关系:Cr2O72-(aq) + H2O(l)![]() 2CrO42- (aq) +2H+(aq)
2CrO42- (aq) +2H+(aq)
(1)写出上述反应的平衡常数表达式:K=_______________________。
(2)向重铬酸钾中加入少量NaOH固体,溶液呈_________色。
(3)向(2)所得的溶液中加入过量的稀硫酸,则溶液呈________色,因为_______________。
(4)向原溶液中加入Ba(NO3)2溶液(BaCrO4为难溶性黄色沉淀),则平衡_________(填“正向移动”、“逆向移动”或“不移动”),溶液颜色将_______________。
【答案】K= 黄 橙红色 加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色 正向移动 变浅
黄 橙红色 加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色 正向移动 变浅
【解析】
在重铬酸钾(K2 Cr2O7)水溶液中橙红色的Cr2O72-与黄色的CrO42-有以下平衡关系:Cr2O72-(aq) + H2O(l)![]() 2CrO42- (aq) +2H+(aq)
2CrO42- (aq) +2H+(aq)
(1)根据Cr2O72-(aq) + H2O(l)![]() 2CrO42- (aq) +2H+(aq),反应的平衡常数表达式:K=
2CrO42- (aq) +2H+(aq),反应的平衡常数表达式:K= 。
。
(2)向重铬酸钾中加入少量NaOH固体,与H+反应,平衡正向移动,溶液呈黄色。
(3)向(2)所得的溶液中加入过量的稀硫酸,H+浓度增大,平衡逆向移动,则溶液呈橙红色,故理由为:加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色。
(4)向原溶液中加入Ba(NO3)2溶液(BaCrO4为难溶性黄色沉淀),CrO42-浓度减小,则平衡正向移动,Cr2O72-浓度减小,溶液颜色将变浅。


科目:高中化学 来源: 题型:
【题目】在一个温度恒定、容积固定的密闭容器中,发生可逆反应
mA(s)+nB(g) ![]() pC(g)+qD(g),已知n=p+q,且该反应为放热反应,反应达到平衡的标志是( )
pC(g)+qD(g),已知n=p+q,且该反应为放热反应,反应达到平衡的标志是( )
①体系的压强不再改变 ②气体的密度不再改变
③各气体的浓度不再改变 ④各气体的质量分数不再改变
⑤反应速率v(C)∶v(D)=p∶q
⑥单位时间内nmol B断键反应,同时pmol C也断键反应
A. ②③④⑥ B. ①②③④ C. ①②③④⑥ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在金刚石压腔实验中创造出了前所未见的化合物X,在超过113 GPa的压力下能够保持稳定。X在一定条件下完全分解为A(气体)和B,A的密度约为0.18 g·L1;B是短周期中最活泼的金属;Y为含有C元素的气态氧化物,能使品红溶液褪色,E为常见无机物,Y与E以1∶1发生化合反应生成F,F仅含三种元素,是常用的食品抗氧化剂之一(假设反应过程无损耗,题中均为短周期元素,A、B、C为单质,气体数据均为标准状况下测定)。根据如下转化,回答下列问题:

(1) 图中C在元素周期表中的位置是________。
(2) D的电子式为________。
(3) X的化学式为________。
(4) E→F的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定反应过程中产生氢气体积V,根据相关数据所绘制的图象如图所示,则曲线a、b、c、d所对应的实验组别可能依次是( )
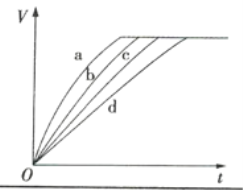
实验组别 | c(HCl)/(mol·L-1) | 温度/℃ | 形状(Fe) |
1 | 2.0 | 30 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 粉末状 |
4 | 2.5 | 30 | 粉末状 |
A.4、3、2、1B.1、2、3、4
C.3、4、2、1D.1、2、4、3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定不同温度下0.5 mol·L-1 CuSO4溶液和0.5 mol·L-1 Na2CO3溶液pH,数据如下表:
温度/℃ | 25 | 30 | 40 | 50 | 60 |
CuSO4(aq) pH | 3.71 | 3.51 | 3.44 | 3.25 | 3.14 |
Na2CO3(aq) pH | 10.41 | 10.30 | 10.28 | 10.25 | 10.18 |
下列说法不正确的是
A. 升高温度,Na2CO3溶液中c(OH-)增大
B. 升高温度,CuSO4溶液和Na2CO3溶液的水解平衡均正向移动
C. 升高温度,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 升高温度,可能导致CO32-结合H+程度大于H2O电离产生H+程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,连二亚硫酸钠又称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如图:
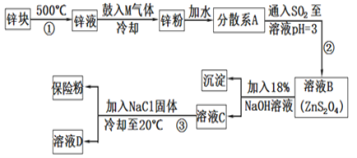
请回答下列问题:
(1)保存连二亚硫酸钠的注意事项___(任写一项)。
(2)鼓入的气体M为空气的一种主要成分,则M的电子式为___;
(3)流程②的化学方程式为__。
(4)流程③的分离方法步骤为过滤、洗涤、干燥。其中洗涤所用试剂是___;实验时加入NaCl固体的作用是__。
(5)连二亚硫酸钠可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),写出该反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在自然界中存在十分广泛,在生物体内亦有极大作用,是组成氨基酸的基本元素之一。氮及其化合物在生产生活中应用广泛。氮的氢化物种类繁多,其中最重要的是氨气,液态氨是一种很好的溶剂,在许多性质方面和水非常相似。
请回答:
![]() 纯水中存在电离平衡:
纯水中存在电离平衡:![]() 。像水一样,纯液氨中也存在着微弱的电离作用,请写出液氨的电离方程式________。
。像水一样,纯液氨中也存在着微弱的电离作用,请写出液氨的电离方程式________。
![]() 金属钠可以从水中置换氢。在铁作催化剂时,金属钠也可以和液氨反应产生氢气和一种离子化合物X,该反应的化学方程式为____________________________,X的电子式是_____________。
金属钠可以从水中置换氢。在铁作催化剂时,金属钠也可以和液氨反应产生氢气和一种离子化合物X,该反应的化学方程式为____________________________,X的电子式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y
A.③B.①②③④C.①②③D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com