
| A. | 金属钾与水反应:2K+2H2O=2K++2OH-+H2↑ | |
| B. | 铜片放入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| C. | 氯气通入碘化钾溶液中:Cl2+2I-=2Cl-+I2 | |
| D. | 醋酸与碳酸钠溶液反应:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ |
分析 A.反应生成KOH和氢气;
B.反应生成硝酸铜、NO和水;
C.反应生成KCl和碘;
D.反应生成醋酸钙、水、二氧化碳.
解答 解:A.金属钾与水反应的离子反应为2K+2H2O=2K++2OH-+H2↑,故A正确;
B.铜片放入稀硝酸中的离子反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故B错误;
C.氯气通入碘化钾溶液中的离子反应为Cl2+2I-=2Cl-+I2,故C正确;
D.醋酸与碳酸钠溶液反应的离子反应为2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑,故的正确;
故选B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
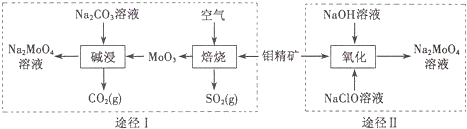
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
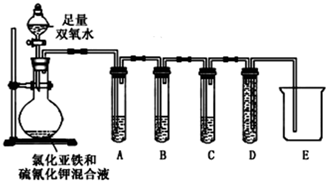
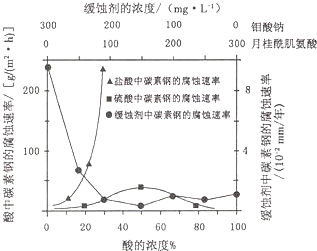
| 实验过程和象限 | 结论 |
| (2)试管A中盛有品红溶液;现象: 品红溶液褪色 | 证明气体中含有SO2 |
| (2)试管B中现象紫色酸性高锰酸钾溶液颜色不变或变浅 ;试管C中现象现象:澄清石灰水变浑浊 | 证明气体中含有CO2 |
| 实验过程 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
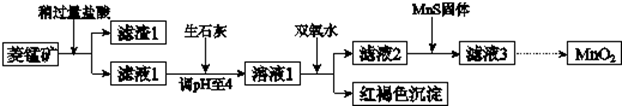
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ag(NH3)2NO3溶液中加人盐酸:Ag(NH3)++2H+═Ag++2NH4+ | |
| B. | 向 Na202 中加人足量水:2Na202+2H20═4Na++40H-+02↑ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++30H-═Al(0H)3↓ | |
| D. | 向 Ca(HC03)2溶液中加入澄淸石灰水:Ca2++2HC03-+20H-═CaC03↓+C032-+2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
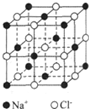 氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示;
氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com