
【题目】实验室用下图所示装置制取氨气。

(1)试管中发生反应的化学方程式是______________________________。
(2)干燥管中盛放的干燥剂是______________________________(填名称)。
(3)实验室中碳酸氢铵加热分解也可以制备氨气,该反应方程式为____________________。
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法中正确的是
A. 2 g H2的分子数为NA
B. 标准状况下,22.4 L H2O含有NA个水分子
C. 7.8 g过氧化钠与足量水反应转移的电子数为0.2NA
D. 1 mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.1 mol某烃在足量的氧气中完全燃烧,生成的CO2和水各0.6 mol,则该烃的分子式为 。
(2)若该烃不能使溴水或高锰酸钾溶液褪色,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,则此烃属于 烃,结构简式为 ,名称是 ,该烃的二氯代物有 种。
(3)若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2,2—二甲基丁烷,则此烃属于 烃,结构简式为 , 名称是 ;
核磁共振氢谱有 个吸收峰,其面积比是 。
下列物质中,与该烃互为同系物的是(填序号)_________,互为同分异构体的是________。
① CH3CH=CHCH3 ② CH2=CHC(CH3)3
③ CH3CH2CH=CHCH2CH3 ④(CH3)2CH(CH2)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素。其相关信息如下
元素 | 相关信息 |
A | A原子的1s 轨道上只有l 个电子 |
B | B是电负性最大的元素 |
C | C的基态原子2p轨道中有三个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式__。
(2)C元素的第一电离能比氧元素的第一电离能_____(填“大”或“小”)。
(3)CA3分子中C原子的杂化轨道类型是__。
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有_____(填序号)。
① 配位键 ② 金属键 ③ 极性共价键 ④非极性共价键 ⑤ 离子键 ⑥ 氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为_______(填字母)
a.平面正方形 b.正四面体 c.三角锥形 d. V 形
(5)B与D可形成离子化合物,其晶胞结构如下图所示。其中D离子的配位数为____, 若该晶体的密度为ag/cm3,则B与D间最短距离是______cm (写出表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课外小组的同学利用下图装置研究铜与稀硝酸的反应。

(1)铜与稀硝酸反应的离子方程式________________________________________。
(2)实验过程中水槽中的集气瓶收集到无色气体,甲同学由此认为铜与稀硝酸反应生成了NO。乙同学认为上述理由不完备,原因是________________________________________(用化学方程式表示)。
(3)同学们经过讨论,决定改用装置B进行反应,实验步骤①~③如下图所示。

步骤③拔去注射器的橡胶帽,拉动活塞吸入少量的空气后,迅速盖上橡胶帽。如果观察到____________________的现象,就能证明铜与稀硝酸反应生成了NO。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:

请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为_______。
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式:____________。
(3)向Ce(BF4)3为中加入KCl溶液的目的是_________。
(4)若溶液中的Ce3+沉淀完全,此时溶液的pH为_______(己知Ksp[Ce(OH)3]=1×10-20)
(5)加热CeCl3·6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是________。
(6)准确称取0.7500g CeCl3样品置于锥形瓶中,加入适量过硫酸铵[(NH4)2S2O8]溶液将Ce3+氧取化为Ce4+,然后用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00mL标准溶液.(己知:Fe2++Ce4+= Ce3++Fe3+)
①已知:过二硫酸的结构式为![]() ,其中S元素的化合价为:______。 过硫酸铵[(NH4)2S2O8]溶液将Ce3+氧化为Ce4+的离子方程式为:_____________。
,其中S元素的化合价为:______。 过硫酸铵[(NH4)2S2O8]溶液将Ce3+氧化为Ce4+的离子方程式为:_____________。
②该样品中CeCl3的质量分数为____________。
③若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质童分数将______ (填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮在自然界中的转化是一个复杂的过程,涉及到地球上生物的方方面面。
(1)下列关于自然界中氮循环(如下图)的说法不正确的是(______)

A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参与了氮循环
(2)汽车尾气中的NO和NO2,是大气污染的物质。
①写出NO造成酸雨的两个化学反应方程式____________________。
②在汽车尾气排放管中安装一个催化转化器,可将尾气中另一种有害气体CO跟NO反应转化为无毒气体,该反应的化学反应方程式______________________________。
③用O2-NaOH吸收法可以除去烟道气中的NO2。反应的化学方程式是______________________________。
(3)用化学方程式表达工业上以NH3为原料生产HNO3的第一步______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用硝酸为原料生产亚硝酸钠的工艺流程如下,等物质的量的NO和NO2恰好能被Na2CO3溶液在吸收塔中完全吸收生成NaNO2。

(1)吸收塔中发生反应的化学方程式是____________________。
(2)分解塔中需要严格控制硝酸的浓度,目的是______________________________。
(3)向母液中加入硝酸,发生反应3NaNO2+2HNO3=3NaNO3+2NO↑+H2O,经结晶可制得副产品NaNO3。对该过程中产生的NO的处理方法是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000 mol·L-1HCl 标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:

(1)若甲同学在实验过程中,记录滴定前滴定管内液面读数为2.10 mL,滴定后液面如图,则此时消耗HCl标准溶液的体积为________ mL。
(2)乙学生做了2组平行实验,数据记录如下:
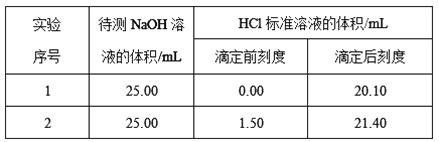
据此计算出待测NaOH溶液的物质的量浓度为____ mol·L-1(小数点后保留四位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com