
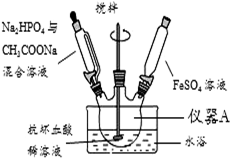
 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).| 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | |
| 溴 | 160 | 3.119 | 58.8 |
| 苯甲醛 | 106 | 1.04 | 179 |
| 1,2-二氯乙烷 | 99 | 1.2351 | 83.5 |
| 间溴苯甲醛 | 185 | 1.587 | 229 |
分析 苯甲醛与溴在氯化铝催化作用下在60℃时反应生成间溴苯甲醛,通式生成HBr,经冷凝回流可到间溴苯甲醛,生成的HBr用氢氧化钠溶液吸收,防止污染空气,有机相中含有Br2,加入HCl,可用碳酸氢钠除去,有机相加入无水MgSO4固体,可起到吸收水的作用,减压蒸馏,可降低沸点,避免温度过高,导致间溴苯甲醛被氧化,以此解答该题.
解答 解:(1)由无水AlCl3、1,2-二氯乙烷和苯甲醛(5.3g)充分混合后,升温至60℃可知,需用水浴加热的方式;因溴易挥发,为使溴充分反应,应进行冷凝回流,以增大产率,反应发生取代反应,生成间溴苯甲醛的同时生成HBr,用氢氧化钠溶液吸收,防止污染空气,
故答案为:水浴加热;导气、冷凝回流;NaOH;
(2)将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合,三种物质中无水AlCl3为催化剂,1,2-二氯乙烷为溶剂,苯甲醛为反应物,
故答案为:催化剂;
(3)将反应混合物含有溴,缓慢加入一定量的稀盐酸中,加入碳酸氢钠,可与Br2、HCl反应,
故答案为:Br2、HCl;
(4)经洗涤的有机相含有水,加入适量无水MgSO4固体,可起到除去有机相的水的作用,
故答案为:除去有机相的水;
(5)减压蒸馏,可降低沸点,避免温度过高,导致间溴苯甲醛被氧化,
故答案为:减压蒸馏;
(6)苯甲醛完全反应生成间溴苯甲醛的理论产量为5.3g×$\frac{185}{106}$,故间溴苯甲醛的产率为$\frac{3.7g}{5.3g×\frac{185}{106}}$×100%=40.0%,
故答案为:40.0%.
点评 本题考查有机物制备实验,涉及对装置及操作的分析评价、物质的分离提纯、产率计算等,难度中等,注意操作规范性及仪器作用.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| C. | 温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 | |
| D. | 将AgCl加入到较浓的KI溶液中,AgCl能转化为AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | MnSO4 | Mn(OH)2 | MnO2 |
| 溶解性或Ksp | 易溶 | 1.9×10-13 | 难溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 名称 | 性状 | 密度 | 溶点℃ | 沸点℃ | 溶解度 | |
| 水 | 乙醚 | |||||
| 环已醇 | 无色,有刺激性气味 | 0.9624 | 25.93 | 161.5 | 5.67g/100mL | ∞ |
| 环已酮 | 无色,有刺激性气味 | 0.9478 | - | 155.7 | 2.4g/100mL | ∞ |
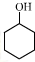 +1 Na2Cr2O7+4H2SO4→3
+1 Na2Cr2O7+4H2SO4→3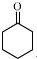 +1 Na2SO4+1 Cr2(SO4)3+7 H2O
+1 Na2SO4+1 Cr2(SO4)3+7 H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
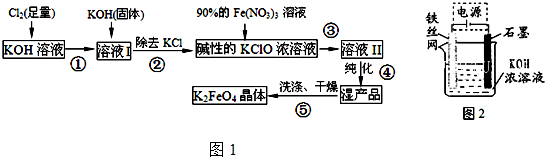
 磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇.主要用于制造磷酸铁锂电池.实验室制备磷酸亚铁的装置示意图如图、反应和实验步骤如下.
磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇.主要用于制造磷酸铁锂电池.实验室制备磷酸亚铁的装置示意图如图、反应和实验步骤如下.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com