

| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
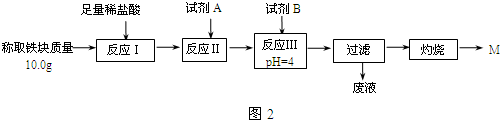
分析 (1)考虑生成的熔融的铁的还原性,可以被空气中的氧气氧化导致生成三价的铁;
(2)根据铝与铁的性质的差异性来选择试剂,并写出反应;
(3)①根据题意可知,本实验要定量检测所得“铁块”的成分,故要通过实验流程,将铁元素完全沉淀;而根据表格可知,要使铁元素完全沉淀而铝和镁不沉淀,需将Fe2+转化为Fe3+,然后沉淀;
②根据Fe(OH)3的Ksp的表达式来进行计算;
③根据10.0g的铁块中的铁元素最终全到了最终红色粉未M中,根据铁原子的守恒来计算;如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,此时应考虑Fe(OH)3的分解,引起计算结果偏小.
解答 解:(1)铝热反应生成的熔融的铁具有很强的还原性,可以被空气中的氧气氧化导致生成三价的铁,
故答案为:熔融的铁被空气中氧气氧化;
(2)要证明“铁块”中含有金属铝,应利用铁和铝性质的差异性,即铁不能和碱反应,而铝可以,故应选择氢氧化钠溶液,与铝反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:氢氧化钠溶液;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)①根据表格可知,要使铁元素完全沉淀而铝离子和镁离子不沉淀,需将Fe2+转化为Fe3+,故需要加入H2O2;然后调节4≤pH<4.2即可将Fe3+沉淀而Al3+、Mg2+不沉淀,调节pH选用的试剂不能用氧化铁,因为会引起红色粉未M的质量偏大;也不能用MgCO3固体,因为MgCO3固体过量时会引起所得固体M则质量偏大,故应选用氨水,
故答案为:C;D;
②根据Fe(OH)3的Ksp=C(Fe3+)•C3(OH-)=1.1×10-36,而pH=4,故C(OH-)=10-10mol/L,带入Ksp=C(Fe3+)•C3(OH-)=1.1×10-36,计算得C(Fe3+)=1.1×10-6mol/L,故答案为:1.1×10-6
③最终红色粉未M为Fe2O3,根据10.0g的铁块中的铁元素最终全到了12.0gFe2O3中,故铁原子的质量为:m(Fe)=$\frac{12.0g}{160g/mol}$×2×56gmol=8.4g
故该“铁块”的纯度=$\frac{8.4g}{10.0g}$×100%=84%;
如果对所得过滤固体直接洗涤、烘干、称量,烘干过程中会引起Fe(OH)3的分解,故会导致计算结果偏小,
故答案为:84%;偏小;Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
点评 本题综合考查了铝热反应、性质实验方案的设计,题目难度中等,注意掌握铝热反应原理,明确性质实验方案设计与评价原则,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发泡塑料饭盒主要材质是高分子材料,不适于盛放含油较多的食品 | |
| B. | 硅太阳能电池板在工作时,可以将化学能转化为电能 | |
| C. | 工业上分别用热还原法、加热法和电解法冶炼镁、铝和铜 | |
| D. | 232Th 转换成233U是化学变化,233U和235U的化学性质几乎相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠的水解反应:HCO3-+OH-?CO32-+H2O | |
| B. | 向澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | Cl2通入热的KOH溶液中制取KClO3:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向含硫燃煤中添加适量CaO可以减少SO2的排放 | |
| B. | 工业氨氧化法制HNO3,每一步都涉及氧化还原反应 | |
| C. | 用Ba(NO3)2溶液鉴别SO32-和SO42- | |
| D. | 往铜粉理逐滴加入稀盐酸,再加入NaNO3溶液后,溶液颜色无变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com