
【题目】下表是常温下,浓度为0.01mol/L的NaOH溶液与几种酸或盐混合后的情况:
混合组别 | 混合前酸或盐的总浓度 | 混合比例及混合溶液性质 |
① | c(HA)=0.02mol/L | 等体积混合,pH>7 |
② | HB溶液的pH=2 | V1mLNaOH溶液与V2mLHB溶液,pH=7 |
③ | c(H2C)=0.01mol/L | 等体积混合,pH>7 |
④ | c(NaHD)=0.01mol/L | 等体积混合,pH=7 |
回答下列问题:
(1)①组混合液中,HA、A-、Na+三种粒子浓度由大到小的顺序为________,若pH=8,则c(Na+)-c(A-)=________mol/L(填具体数字)。
(2)由②组混合液pH=7可推知,V1____V2。
(3)③组混合液中,pH>7的原因是______________________。
(4)0.01mol/LNaHD溶液中,水的电离度=_________。(已知:水的电离度=[已电离的水分子的个数/水分子总数]×100%)
(5)仅凭上述结果,一定能确定HA、HB、H2C、H2D四种酸中属于弱酸的是_________。
【答案】 c(HA)>c(Na+)>c(A-) 9.9×10-7 ≥ HC的水解大于其电离 1.8×10-14 HA、H2C
【解析】(1)①组等体积等浓度混合,得到等量的HA、NaA,溶液的pH>7,水解显碱性,则离子浓度为c(HA)>c(Na+)>c(A-);若pH=8,则c(H+)=10-8mol/L,c(OH-)=10-6mol/L,根据电荷守恒有c(Na+)+ c(H+)= c(A-)+ c(OH-),则c(Na+)-c(A-)= c(OH-)- c(H+)=10-6mol/L -10-8mol/L =9.9×10-7mol/L;(2)若HB为强酸,pH=7,等体积混合;若HB为弱酸,HB的浓度大于0.01mol/L,则酸的体积小可保证pH=7,即V1≥V2;(3)③组混合液中,pH>7的原因是生成 NaHC溶液,而HC-的水解大于其电离,溶液呈碱性;(4)由等体积等浓度混合pH=7,则NaHD完全电离,c(H+)=0.01mol/L,由水电离出的c(H+)=10-12mol/L,1L水电离出n(H+)=10-12mol,1L水的物质的量为![]() ,则水的电离度为:
,则水的电离度为:  ;(5)根据表中数据可知:A、C组中的酸在溶液中只能部分电离,一定为弱酸;而B组中不能确定,D组中为强酸,所以属于弱酸的为:HA、H2C。
;(5)根据表中数据可知:A、C组中的酸在溶液中只能部分电离,一定为弱酸;而B组中不能确定,D组中为强酸,所以属于弱酸的为:HA、H2C。


科目:高中化学 来源: 题型:
【题目】一氯化碘是一种红棕色液体,不溶于水,溶于乙醇和乙酸,能与KI反应生成I2,用于测定油脂中的碘值等(注:碘值表示有机物中不饱和程度的指标)。某校研究性学习小组的同学拟制备一氯化碘(沸点101 ℃)。回答下列问题:
(1)甲组同学拟利用干燥纯净的氯气与碘反应制备一氯化碘,已知碘与氯气的反应为放热反应,其装置如下:
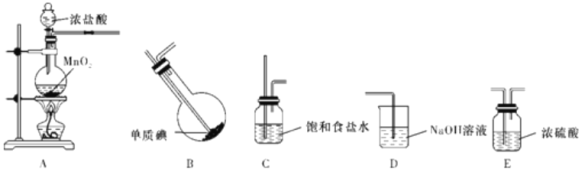
①各装置连接顺序为A→_______________________;
A中发生反应的离子方程式为________________________。
②B装置烧瓶需放在冷水中,其目的是________________________;
D装置的作用是________________________。
③B装置得到的液态产物进一步提纯可得到较纯净的ICl,采取的方法是_____。
(2)乙组同学采用最新报道制一氯化碘的方法,在三颈烧瓶中加入粗碘和盐酸,控制温度约50 ℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘,则发生反应的化学方程式为_________________________。
(3)设计实验证明:ICl的氧化性比I2强:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)。已知:实验室可用下列反应制取氧气2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
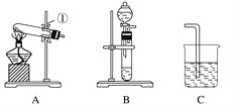
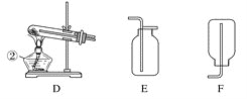
(1)写出仪器名称:①________,②________。
(2)实验室制取并收集氧气时,应选择____________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验时,应选择________和________相连接,检验生成气体时使用的试剂是________,检验气体时观察到的实验现象是_________________。
(4)制取氢气并做还原氧化铜的实验时,应选择______和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.8 g CO和H2混合气体,在足量的氧气中燃烧,产物全部通过足量的Na2O2,则Na2O2增重
A. 2 g B. 3.8 g C. 5 g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物W对肝癌的治疗具有很好的效果,一种合成药物W的路线如下:

已知以下信息:
①2HCHO+NaOH→CH3OH+HCOONa
②![]()
③丁烯二酸酐的结构筒式为![]()
回答下列问题:
(1)有机物A中含有的官能团有碳碳双键、________(填名称)。
(2)第①步反应中除生成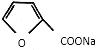 外,还生成另一产物,此产物的结构简式为________。
外,还生成另一产物,此产物的结构简式为________。
(3)H的结构简式为___________。
(4)第⑤步的反应类型是____________。
(5)L是药物W的同分异构体,同时满足下列条件的L有_____种(不考虑立体异构);
①分子中含有苯环,苯环上有4个取代基
②既能与FeCl3溶液发生显色反应,又能与NaHCO3溶液反应生成气体
③1mol L能与3molNaOH完全反应
其中核磁共振氢谱为四组峰,峰面积比为1:2:2:3的结构简式为_________。
(6)写出由![]() 制备丁烯二酸酐
制备丁烯二酸酐![]() 的合成路线:___________(其他试剂任选)。
的合成路线:___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。只改变一个条件,则下列对图像的解读正确的是
①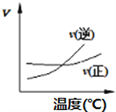 ②
②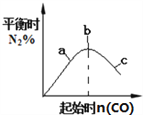 ③
③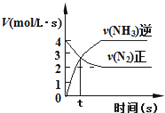 ④
④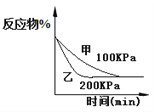
A. A2(g)+3B2(g)![]() 2AB3(g),如图①说明此反应的正反应是吸热反应
2AB3(g),如图①说明此反应的正反应是吸热反应
B. 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),如图②说明NO2的转化率b>a>c
N2(g)+4CO2(g),如图②说明NO2的转化率b>a>c
C. N2(g)+3H2(g)![]() 2NH3(g),如图③说明t秒时合成氨反应达到平衡
2NH3(g),如图③说明t秒时合成氨反应达到平衡
D. 2A(g)+2B(g)![]() 3C(g)+D(?),如图④说明生成物D一定是气体
3C(g)+D(?),如图④说明生成物D一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. 0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)十3c(HCO3-)+3c(H2CO3)
C. 0.1mol/LNH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
D. 0.1mol/LNa2C2O4溶液与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com