
ĪŖ³ä·ÖĄūÓĆŗ£Ńó׏Ō“£¬ŃŠ¾æČĖŌ±·¢Ć÷ŗ£Ė®µē³Ų£¬ÕāÖÖµē³ŲÄÜĄūÓƵĖ®Óėŗ£Ė®Ö®¼äŗ¬ŃĪĮæ²ī±š½ųŠŠ·¢µē£¬ŌŚŗ£Ė®ÖŠµē³Ų×Ü·“Ó¦æɱķŹ¾ĪŖ£ŗ5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
A£®øŗ¼«·“Ó¦Ź½£ŗ Ag+Cl£e££½AgCl
B£®ĆæÉś³É1 mol Na2Mn5O10×ŖŅĘ2 molµē×Ó
C£®Na2Mn5O10ŹĒ»¹Ō²śĪļ
D£®Cl£²»¶ĻĻņµē³ŲµÄÕż¼«ŅʶÆ

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģɽĪ÷Ę½Ņ£ÖŠŃ§µČÖŲµć֊ѧøßČżµŚČż“ĪĮ·±ų»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĖÄÖÖ¶ĢÖÜĘŚŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆČēĶ¼£¬ĘäÖŠÖ»ÓŠMŌŖĖŲ×īĶā²ćµē×ÓŹżÓėµē×Ó²ćŹżĻąµČ£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
Y | Z | ||
M | X |
A£®Ō×Ó°ė¾¶Z<M
B£®·Ē½šŹōŠŌ£ŗX<Z
C£®MŌŖĖŲ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļ¾ßÓŠĮ½ŠŌ
D£®YµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļµÄĖįŠŌ±ČXµÄČõ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğŗžÄĻ¶žŠ£øßŅ»ĄķæĘŹµŃé°ąÉĻĮŖæ¼2»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
ŌŚ»Æѧъ¾æĮģÓņ£¬¾³£ŠčŅŖ¶ŌŅ»Š©ĪļÖŹ½ųŠŠŠŌÖŹµÄČ·¶Ø”£ČēĄūÓĆĻĀĮŠ×°ÖĆ£Ø¼Š³ÖŅĒĘ÷ŅŃĀŌČ„£©²ā³öŅ»¶ØÖŹĮæĆ¾ÓėŃĪĖį·“Ó¦·Å³öµÄĘųĢåĢå»ż£¬¶Ō½šŹōĆ¾µÄĻą¶ŌŌ×ÓÖŹĮæ½ųŠŠ²ā¶Ø£¬ŹµŃé²½ÖčČēĻĀ£ŗ
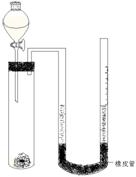
¢Ł×¼Č·³ĘĮæm g½šŹōĆ¾£ØŅŃ³żČ„±ķĆęŃõ»ÆĤ£©£¬ÓĆĶĶų°ü×”·ÅČėøɾ»µÄŹŌ¹ÜÖŠ£»
¢Ś°“Ķ¼Ź¾×é×°ŗĆ×°ÖĆ£¬Č»ŗóŌŚ¹Ų±Õ»īČūµÄ·ÖŅŗĀ©¶·ÖŠ×°ČėŅ»¶ØĢå»ż2 mol/LµÄŃĪĖį£»
¢Ūµ÷ÕūÓŅ±ß²£Į§¹Ü£Ø“ų¾łŌČæĢ¶ČÖµ£©£¬ČĆUŠĶ¹ÜĮ½¶ĖŅŗĆęŌŚĶ¬Ņ»Ė®Ę½Ćę£¬¶Į³öÓŅ±ß²£Į§¹ÜµÄŅŗĆęæĢ¶ČÖµĪŖV1mL£»
¢Ü“ņæŖ·ÖŅŗĀ©¶·»īČū£¬ČĆŅ»¶ØĮæµÄŃĪĖį½ųČėŹŌ¹ÜÖŠŗóĮ¢¼“¹Ų±Õ»īČū£»
¢Żµ±Ć¾Ģõ·“Ó¦Ķźŗó£¬ £¬£Ø2·Ö£©¶Į³öÓŅ±ß²£Į§¹ÜµÄŅŗĆęæĢ¶ČĪŖV2 mL”£
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öÄćČĻĪŖ²½Öč¢ŻÖŠæÕøńÓ¦½ųŠŠµÄ²Ł×÷ ”££Ø2·Ö£©
£Ø2£©ČōV1,V2¾łŹĒÕŪĖćĪŖ±źæöĻĀµÄÖµ£¬ŌņĆ¾µÄĻą¶ŌŌ×ÓÖŹĮæAr(Mg)µÄŹµŃé²ā¶Ø±ķ“ļŹ½ĪŖAr(Mg)£½ £¬ÄćČĻĪŖ“Ė±ķ“ļŹ½Ēó³öµÄÖµŹĒ·ń×¼Č·£æ £ØĢī”®ŹĒ”Æ»ņ”®²»”Æ£©£¬Ö÷ŅŖĪŹĢāĪŖ £ØČō»Ų“š”®ŹĒ”ÆŌņ“ĖæÕ²»Ģī£©”££Ø2+1+1=4·Ö£©
£Ø3£©²½Öč¢ŁÖŠ£¬ĪŖŹ²Ć“ŅŖÓĆĶĶų°ü×”Ć¾Ģõ£æ ”££Ø2·Ö£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016±±¾©“óѧø½ÖŠÓī»Ŗ½ĢÓż¼ÆĶÅøßŅ»12ŌĀ»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø1£©Ņ»¶ØĪĀ¶ČĻĀ£¬ÓŠa.ŃĪĖį£»b.ĮņĖį£»c.“×ĖįČżÖÖĖį£¬ÓĆ×ÖÄøĢīŠ“ĻĀĮŠæÕøń£ŗ
¢Łµ±ČżÖÖĖįĪļÖŹµÄĮæÅضČĻąĶ¬Ź±£¬c(H£«)Óɓ󵽊”µÄĖ³ŠņŹĒ________________________”£
¢ŚČōČżÕßc(H£«)ĻąĶ¬Ź±£¬ĪļÖŹµÄĮæÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ_________________________”£
£Ø2£©³£ĪĀĻĀ£¬0.1 mol”¤L£1µÄHClČÜŅŗÖŠ£¬ÓÉĖ®µēĄė³öĄ“µÄH£«ÅضČĪŖ________mol”¤L£1”£
£Ø3£©ŌŚŅ»ŌŖĒæ¼īMOHČÜŅŗÖŠ¼ÓČėŅ»ŌŖĖįHAČÜŅŗ£¬³ä·Ö·“Ó¦ŗó£¬ČÜŅŗ³ŹÖŠŠŌ”£¼×Ķ¬Ń§ČĻĪŖČÜŅŗÖŠc(A£)£½c(M£«)£¬¶ųŅŅĶ¬Ń§ČĻĪŖc(A£)ŗĶc(M£«)ŹĒ·ńĻąµČ£¬ŅŖæ“Ņ»ŌŖĖįHAŹĒĒæĖį»¹ŹĒČõĖį”£ÄćČĻĪŖ__________Ķ¬Ń§µÄĖµ·ØÕżČ·£¬ĄķÓÉŹĒ____________________________”£
£Ø4£©Ć÷·Æ[KAl(SO4)2”¤12H2O]³£ÓĆ×÷¾» Ė®¼Į£¬ĘäŌĄķŹĒ_______________(ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾)”£
Ė®¼Į£¬ĘäŌĄķŹĒ_______________(ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾)”£
£Ø5£©½«FeCl3ČÜŅŗÕōøɲ¢×ĘÉÕ£¬×īÖÕµĆµ½µÄ¹ĢĢåĪļÖŹŹĒ______________________(ĢīŠ“»ÆѧŹ½)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016±±¾©“óѧø½ÖŠÓī»Ŗ½ĢÓż¼ÆĶÅø߶ž12ŌĀ»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŌŚ2A£Øg£©+B£Øg£©=3C£Øg£©+4D£Øg£©ÖŠ£¬±ķŹ¾øĆ·“Ó¦ĖŁĀŹ×īæģµÄŹĒ£Ø £©
A£®v£ØA £©=0.5mol•L©1£®mim©1
£©=0.5mol•L©1£®mim©1
B£®v£Ø B£©=0.3mol•L©1£®mim©1
B£©=0.3mol•L©1£®mim©1
C£®v£ØC£©=0.8mol•L©1£®mim©1
D£®v£ØD£©=1.0mol•L©1£®mim©1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğ¹óÖŻŹ”ø߶žÉĻ¶ž“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠÓŠ¹ŲŹµŃéµÄ×ö·ØÕżČ·µÄŹĒ
A£®ÓĆpHŹŌÖ½²āĀČĖ®µÄpH
B£®ÓĆĶŠÅĢĢģĘ½³ĘČ”5.72 g NaCl¾§Ģå
C£®ÓĆĖįŹ½µĪ¶Ø¹ÜĮæČ”20.00 mLµÄĖįŠŌKMnO4ČÜŅŗ
D£®ÓĆ“ųÄ„æŚ²£Į§ČūµÄŹŌ¼ĮĘæ±£“ęNa2CO3ČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğĮÉÄžŹµŃé֊ѧ·ÖŠ£øßŅ»ÉĻ12ŌĀŌĀæ¼»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
¹żĮæµÄNaHCO3ŗĶNa2O2»ģŗĻ£¬ŌŚĆܱÕČŻĘ÷ÖŠ³ä·Ö»ģŗĻ¼ÓČČŗó£¬×īŗóÅųöĘųĢ壬²ŠĮōµÄ¹ĢĢåŹĒ
A£®Na2O B£® Na2CO3 C£®Na2O2ŗĶNa2CO3 D£®Na2O2ŗĶNa2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğŗÓ±±Ź”ø߶žÉĻĘŚÖŠ²āŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
£Øøıą£©ŌŚĻ”ĮņĖįÓėŠæ·“Ó¦ÖĘČ”ĒāĘųµÄŹµŃéÖŠ£¬Ģ½¾æ¼ÓČėĮņĖįĶČÜŅŗµÄĮæ¶ŌĒāĘųÉś³ÉĖŁĀŹµÄÓ°Ļģ”£ŹµŃéÖŠZnĮ£¹żĮæĒŅæÅĮ£“óŠ”ĻąĶ¬£¬±„ŗĶĮņĖįĶČÜŅŗÓĆĮæ0”«4.0mL£¬±£³ÖČÜŅŗ×ÜĢå»żĪŖ100.0mL£¬¼ĒĀ¼»ńµĆĻąĶ¬Ģå»ż£Ø336mL£©µÄĘųĢåĖłŠčŹ±¼ä£¬ŹµŃé½į¹ūČēĶ¼ĖłŹ¾£ØĘųĢåĢå»ż¾ł×Ŗ»ÆĪŖ±źæöĻĀ£©”£¾ŻĶ¼·ÖĪö£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
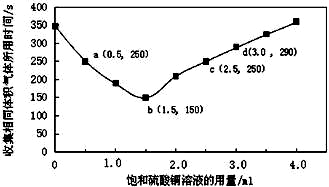
A£®±„ŗĶĮņĖįĶČÜŅŗÓĆĮæ¹ż¶ą²»ĄūÓŚøüæģŹÕ¼ÆĒāĘų
B£®a”¢cĮ½µć¶ŌÓ¦µÄĒāĘųÉś³ÉĖŁĀŹĻąµČ
C£®bµć¶ŌÓ¦µÄ·“Ó¦ĖŁĀŹĪŖv£ØH2SO4£© = 1.0”Į10-3 mol”¤L-1”¤s-1
D£®dµćƻӊ¹¹³ÉŌµē³Ų£¬·“Ó¦ĖŁĀŹ¼õĀż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģ½Ī÷Ź”øßČżÉĻѧʌʌ֊²āŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
ŃĒĀČĖįÄĘ£ØNaClO2£©ŹĒÖŲŅŖµÄĘÆ°×¼Į£¬Ģ½¾æŠ”×éæŖÕ¹ČēĻĀŹµŃ飬»Ų“šĻĀĮŠĪŹĢā£ŗ 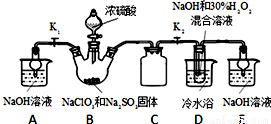
ŅŃÖŖ£ŗNaClO2±„ŗĶČÜŅŗŌŚµĶÓŚ38”ꏱĪö³öNaClO2•3H2O£¬øßÓŚ38”ꏱĪö³öNaClO2£¬øßÓŚ60”ꏱNaClO2·Ö½ā³ÉNaClO3ŗĶNaCl£®
£Ø1£©×°ÖĆCµÄ×÷ÓĆŹĒ______________£¬Čē¹ū³·Č„DÖŠµÄĄäĖ®Ō”£¬æÉÄܵ¼ÖĀ²śĘ·ÖŠ»ģÓŠµÄŌÓÖŹŹĒ __________”£
£Ø2£©ŅŃÖŖ×°ÖĆBÖŠµÄ²śĪļÓŠClO2ĘųĢ壬Ōņ×°ÖĆBÖŠ·“Ó¦µÄ·½³ĢŹ½ĪŖ__________£»×°ÖĆDÖŠ·“Ӧɜ³ÉNaClO2µÄ»Æѧ·½³ĢŹ½ĪŖ__________”£
£Ø3£©·“Ó¦ŗóµÄČÜŅŗÖŠŅõĄė×Ó³żĮĖClO2-”¢ClO3-”¢Cl-”¢ClO-”¢OH-Ķā»¹æÉÄÜŗ¬ÓŠµÄŅ»ÖÖŅõĄė×ÓŹĒ______£»¼ģ Ńé øĆĄė×ӵķ½·ØŹĒ_______”£
£Ø4£©Ēė²¹³ä“Ó×°ÖĆD·“Ó¦ŗóµÄČÜŅŗÖŠ»ńµĆNaClO2¾§ĢåµÄ²Ł×÷²½Öč”£
¢Ł¼õŃ¹£¬55”ęÕō·¢½į¾§£»¢Ś_______£»¢ŪÓĆ38”ꔫ60”ęČČĖ®Ļ“µÓ£»¢Ü_________µĆµ½³ÉĘ·”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com