
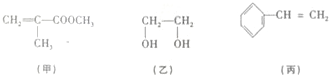
 “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )| A. | 甲物质在一定条件下可以生成有机高分子化合物 | |
| B. | 1mol乙物质可与2mol钠完全反应生成1mol氢气 | |
| C. | 甲、丙物质都能使溴的四氯化碳溶液褪色 | |
| D. | 甲在酸性条件下水解产物之一与乙互为同系物 |
分析 A.甲含有碳碳双键,可发生加聚反应;
B.乙含有2个羟基,可与钠反应生成氢气;
C.甲、丙含有碳碳双键,可发生加成反应,
D.甲在酸性条件下水解产物为CH2=C(CH3)COOH和CH3OH;
解答 解:A.甲含有碳碳双键,可发生加聚反应生成有机高分子化合物,故A正确;
B.乙含有2个羟基,可与钠反应生成氢气,1mol乙物质可与2mol钠完全反应生成1mol氢气,故B正确;
C.甲、丙含有碳碳双键,可发生加成反应,故C正确,
D.甲在酸性条件下水解产物为CH2=C(CH3)COOH和CH3OH,与乙结构不同,不是同系物,故D错误.
故选D.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构特点和官能团的性质,为解答该题的关键,难度不大.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C3H6 | C. | C2H6 | D. | C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
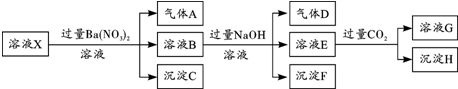
| A. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| B. | 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- | |
| C. | 溶液X中一定含有Al3+、NH4+、Fe2+、SO42-、H+ | |
| D. | 若溶液X为100 mL,产生的气体A为44.8 mL(标况),则X中c(Fe2+)=0.06 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱 | |
| C. | 硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com