
在50 mL a mol/L的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO![]() )=3 mol/L.
)=3 mol/L.
(1)求稀释后的溶液pH=________.
(2)若a=9,则生成的气体中NO2的物质的量为________mol.
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH![]() 2NaNO2+H2O
2NaNO2+H2O
2NO2+2NaOH![]() NaNO2+NaNO3+H2O
NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1 mol/L的NaOH恰好被吸收,NaOH溶液的体积为________mL.
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
(16分)下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)
| A |
|
| |||||||||||||||
|
|
|
|
| W | T | M |
|
| |||||||||
| B | D |
| Z | J | L | U | V | R | |||||||||
| X | E |
|
|
|
|
| Y |
|
| G |
|
|
|
|
| Q |
|
(1)化学性质最不活泼的单质是 ,金属氢氧化物中碱性最强的是 ,
属于过渡元素的是 (填字母),J在周期表中的位置 。
(2)A 分别和L、M、T形成的化合物稳定性强弱顺序 > > ,
L、U、V的最高价氧化物对应水化物的酸性强弱顺序 > > 。
(3)V、Q形成的简单阴离子还原性强弱顺序 > ,
D、M、U、V形成的简单离子半径大小顺序 > > > 。
(4)写出Z、B分别形成的最高价氧化物对应水化物相互反应的离子方程式:
。
(5)已知G为常见的红色金属单质,现取7.68g G和50 mL 的浓硝酸反应,当G反应完毕时,溶液体积基本不变,共收集到气体的体积是3.36 L(标准状况,不考虑N2O4),剩余溶液中c(H+)= 2.2 mol/L,则原硝酸溶液的浓度为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省新海高级中学高一下学期期中考试化学试卷(带解析) 题型:填空题
(16分)下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)
| A | | | |||||||||||||||
| | | | | W | T | M | | | |||||||||
| B | D | | Z | J | L | U | V | R | |||||||||
| X | E | | | | | | Y | | | G | | | | | | Q | |
查看答案和解析>>
科目:高中化学 来源:2014届江苏省高一下学期期中考试化学试卷(解析版) 题型:填空题
(16分)下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)
|
A |
|
|
|||||||||||||||
|
|
|
|
|
W |
T |
M |
|
|
|||||||||
|
B |
D |
|
Z |
J |
L |
U |
V |
R |
|||||||||
|
X |
E |
|
|
|
|
|
Y |
|
|
G |
|
|
|
|
|
Q |
|
(1)化学性质最不活泼的单质是 ,金属氢氧化物中碱性最强的是 ,
属于过渡元素的是 (填字母),J在周期表中的位置 。
(2)A 分别和L、M、T形成的化合物稳定性强弱顺序 > > ,
L、U、V的最高价氧化物对应水化物的酸性强弱顺序 > > 。
(3)V、Q形成的简单阴离子还原性强弱顺序 > ,
D、M、U、V形成的简单离子半径大小顺序 > > > 。
(4)写出Z、B分别形成的最高价氧化物对应水化物相互反应的离子方程式:
。
(5)已知G为常见的红色金属单质,现取7.68g G和50 mL 的浓硝酸反应,当G反应完毕时,溶液体积基本不变,共收集到气体的体积是3.36 L(标准状况,不考虑N2O4),剩余溶液中c(H+)= 2.2 mol/L,则原硝酸溶液的浓度为 。
查看答案和解析>>
科目:高中化学 来源:专项题 题型:实验题
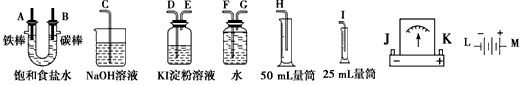
查看答案和解析>>
科目:高中化学 来源: 题型:
2gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol/LKMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量简中液体的体积是________mL。图II表示50mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amL B.是(50-a)mL
C. 一定大于amL D.一定大于(50-a)mL
(2)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:

MnO4-+ Fe2++ H+= Mn2++ Fe3++ H2O
(3)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(4)欲配制500mL0.1mol/LFe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。
(5)混合物中Cu2S的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com