
【题目】请仔细观察下列几种物质的结构示意图,判断下列说法正确的是
A. 硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为
硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为![]()
B. 锂的某种氧化物晶胞如图所示,则该氧化物的化学式为
锂的某种氧化物晶胞如图所示,则该氧化物的化学式为![]()
C. 某晶体的一部分如图所示,则这种晶体中A、B、C三种粒子数之比是3:9:4
某晶体的一部分如图所示,则这种晶体中A、B、C三种粒子数之比是3:9:4
D. Mn和Bi形成的某种晶体的结构示意图如图所示
Mn和Bi形成的某种晶体的结构示意图如图所示![]() 白球均在六棱柱内
白球均在六棱柱内![]() ,则该晶体物质的化学式为
,则该晶体物质的化学式为![]()
科目:高中化学 来源: 题型:
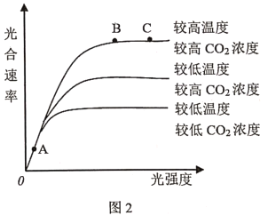
【题目】卡尔文循环过程如图1所示,探究各种环境因素对光合作用的综合影响结果如图2所示。请分析回答:
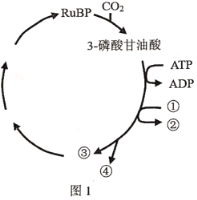
(1)图1过程在叶绿体的________中进行,RuBP的组成元素是________,![]() 和RuBP结合产生3-磷酸甘油酸的过程________(需要(不需要)消耗ATP。
和RuBP结合产生3-磷酸甘油酸的过程________(需要(不需要)消耗ATP。
(2)图1中的物质①可以为3-磷酸甘油酸的还原提供________,每生成1分子物质④需要经过________轮卡尔文循环,此时有________分子物质③用于RuBP的再生。
(3)图2中的自变量为________,限制A点光合速率的主要因素是________;若由A点条件变为B点条件,则短时间内3-磷酸甘油酸的生成速率________(增大/减小/基本不变);若由B点条件变为C点条件,则短时间内3-磷酸甘油酸的生成速率________(增大/减小基本不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍,工艺流程如下

回答下列问题:
(1)“酸溶”时,溶液中有Fe3+、Fe2+、Ni2+等生成,废渣的主要成分是__________;金属镍溶解的离子方程式为__________________________________________。
(2)“除铁”时H2O2的作用是___________________,加入碳酸钠的目的是__________________________________________。
(3)“除铜”时,反应的离子方程式为_____________________________________,若用Na2S代替H2S除铜,优点是__________。
(4)已知除钙镁过程在陶瓷容器中进行,NaF的实际用量不能过多的理由为_____________________。
(5)已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程在“沉镍”过程中需调节溶液pH约为_______,Ni2+才刚好沉淀完全(离子沉淀完全的浓度≤10-5 mol/L;lg2=0.30)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《化学与生活》合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
(1)蛋白质是人体必需的营养物质,它在人体内最终分解为_______
A.葡萄糖 B.氨基酸 C.脂肪酸
(2)现有下列五种物质:
A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.青霉素
请按下列要求填空(填序号)。
富含维生素C的是________;可直接进入血液,补充能量的是_______ ;应用最广泛的抗生素之一的是_______;即可作为调味剂,又可作为防腐剂的是_______;食用过多会引起血压升高、肾脏受损的_________。
(3)鸡蛋含有丰富的蛋白质,它在人体内消化过程如下:
![]()
请回答下列问题:
a.向鸡蛋清溶液中滴入几滴浓硝酸,微热,鸡蛋清变为________色。
b.氨基酸具有两性,是因为氨基酸分子中既含有碱性官能团又含有酸性官能团,其中,碱性官能团是____________,酸性官能团是____________。
c.向鸡蛋清溶液中加入饱和Na2SO4溶液,有白色沉淀产生,发生的是_______(填“盐析”或“变性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。

已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为____。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;写出AgNO3溶液中发生反应的化学方程式:____。
(3)硬质玻璃管中的反应现象为____,反应的化学方程式为____。
(4)装置中空试管的作用是____。
(5)实验中,观察到紫色石蕊溶液颜色的变化为____。
(6)烧杯中氢氧化钠溶液的作用是___,发生反应的化学方程式为_____。
(7)盛水的试管中,溶液最后的颜色为___,说明氯气____(填“能”或“不能”)溶于水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的方案可以降低铁闸门的腐蚀速率。下列判断正确的是( )
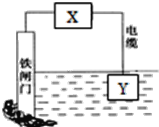
A.若X为导线,Y可以是锌
B.若X为导线,铁闸门上的电极反应式为Fe-2e-=Fe2+
C.若X为直流电源,铁闸门做负极
D.若X为直流电源,Y极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下检测方法。回答下列问题:将vL气样通入适量酸化的H2O2溶液中,恰好使NOx完全被氧化成NO3-,加水稀释至100.00mL。量取20.00mL该溶液,加入v1mLc1mol·L-1FeSO4标准溶液(过量),充分反应后,用c2mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2mL。
(1)NO被H2O2氧化为NO3-的离子方程式为___。
(2)加水稀释到100.00ml所用的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要___;滴定操作使用的玻璃仪器主要有___。
(3)滴定过程中发生下列反应:3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O、Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中NOx的物质的量为___mol。
(4)下列操作会使滴定结果偏高的是___
A.滴定管未用标准液润洗
B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数
D.FeSO4标准溶液部分变质
II、常温下,用酚酞作指示剂,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。

(已知:CH3COOH、 HCN的电离平衡常数分别为1.75×10-5、6.4×10-10)
(1)图___(a或b)是NaOH溶液滴定HCN溶液的pH变化的曲线。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:___。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)___c(HCN)-c(CH3COOH)(填“>、<或=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-H++A2-。
①NaHA溶液的pH___(填大于、小于或等于)Na2A溶液的pH。
②某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是__。
A.c(H+)c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq)ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有___。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
(2)常温下,若在0.10molL-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___molL-1(Ksp[Cu(OH)2]=2.2×10-20)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com