
分析 ①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O中,Mn元素的化合价由+4价降低到+2价,Cl元素的化合价由-1价升高到0价;
②2Al+3H2SO4═Al2(SO4)3+3H2↑中,Al元素的化合价升高,H元素非化合价降低,转移的电子数为6e-.
解答 解:①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,氧化剂为MnO2,MnCl2为还原产物,Cl元素的化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,则1mol氧化剂反应转移2mol2e-,用双线桥法表示反应中电子转移的数目为 ,
,
答:双线桥法表示为 ;
;
②2Al+3H2SO4═Al2(SO4)3+3H2↑中,Al元素的化合价升高,H元素非化合价降低,转移的电子数为6e-,电子转移的方向和数目为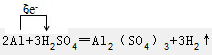 ,
,
答:单线桥法表示为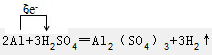 .
.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应电子转移方向和数目的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制90mL1.00mol/L的NaCl溶液,用托盘天平称取5.3gNaCl固体 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应当坩埚中有大量固体析出时移走酒精灯用余热蒸干 | |
| C. | 先在天平两个托盘上各放一张相同质量的滤纸,再把氢氧化钠固体放在滤纸上称量 | |
| D. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液最终变为黄色. |
| Ⅱ | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色. |
| Ⅲ | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成. |
| Ⅳ | 一段时间后,用注射器取出少量B装置中的溶液,… | … |
| Ⅴ | 打开活塞a,通入一段时间空气 | ---- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙和盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| B. | 向氢氧化钡溶液中加入硫酸溶液 SO42-+Ba2+═BaSO4↓ | |
| C. | 向稀盐酸溶液中加铁 3Fe+6H+═3H2↑+3Fe3+ | |
| D. | 向硝酸银溶液中加盐酸 Ag++Cl-═AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容 器 编 号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | 三个容器内反应的平衡常数③>①>② | B. | 放出热量a<b<92.4 | ||
| C. | N2的转化率①<② | D. | 达平衡时氨气的体积分数①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | X元素形成的气态氢化物分子的空间结构是三角形 | |
| B. | Z与W元素形成的化合物是分子晶体 | |
| C. | W单质受热蒸发时吸收的热量用于克服共价键 | |
| D. | 化合物XW3中W的化合价为-1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com