

���� ��1������������;ѡȡ������
��2��װ��C�������ǰ�ȫƿ���з��������ã�
��3��װ��B���Ʊ��õ�ClO2������B�з�ӦΪNaClO3��Na2SO3��ŨH2SO4���������� ClO2��Na2SO4���������Ⱥ��������Ʒ�Ӧ����NaClO2��
��4������Ŀ��Ϣ��֪��Ӧ�����¶�38�桫60�棬����60��ʱNaClO2�ֽ��NaClO3��NaCl��
��5����װ��D����Һ���NaClO2���壬��Ҫ�����ᾧ�����ȹ��ˡ�ϴ�ӡ����
��6��B�п��ܷ���Na2SO3+H2SO4��Ũ��=Na2SO4+SO2��+H2O��������SO2 ������D�У�SO2��H2O2 ��Ӧ���������ƣ�
��7���ٵ������۱���ɫ����Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��Na2S2O3��Һʱ��Һ��ɫǡ����ȥ�Ұ�����ڲ���ԭ��˵������ζ��յ㣻
�ڸ��ݻ�ѧ��Ӧ�ɵù�ϵʽ��NaClO2��2I2��4S2O32-������Ʒ��NaClO2�����ʵ���x�����ݹ�ϵʽ���㣮
��� �⣺��1����50%˫��ˮ����30%��H2O2��Һ����Ҫ����������Ͳ���ձ���������������ιܣ����Ի���Ҫ��Ͳ��
�ʴ�Ϊ����Ͳ��
��2��װ��C�������ǰ�ȫƿ����ֹDƿ��Һ������Bƿ�У�
�ʴ�Ϊ����ֹDƿ��Һ������Bƿ�У���ȫƿ����
��3��װ��B���Ʊ��õ�ClO2������B�з�ӦΪNaClO3��Na2SO3��ŨH2SO4���������� ClO2��Na2SO4����Ӧ�ķ���ʽΪ2NaClO3+Na2SO3+H2SO4=2 ClO2��+2Na2SO4+H2O���������Ⱥ�˫��ˮ���������Ʒ�Ӧ����NaClO2����Ӧ����ʽΪ2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O��
�ʴ�Ϊ��2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O��
��4������Ŀ��Ϣ��֪��Ӧ�����¶�38�桫60�棬����60��ʱNaClO2�ֽ��NaClO3��NaCl�����������ȥD�е���ˮԡ�����ܵ��²�Ʒ�л��е�������NaClO3��NaCl��
�ʴ�Ϊ��NaClO3��NaCl��
��5����װ��D����Һ���NaClO2���壬��Ҫ�����ᾧ�����ȹ��ˡ�ϴ�ӡ�������������Ե�iii��������45�����ҵ���ˮϴ��3�飨��ˮ�¶ȸ���38�棬����60�棩��
�ʴ�Ϊ����45�����ҵ���ˮϴ��3�飨��ˮ�¶ȸ���38�棬����60�棩��
��6��B�п��ܷ���Na2SO3+H2SO4��Ũ��=Na2SO4+SO2��+H2O��������SO2 ������D�У�SO2��H2O2 ��Ӧ���������ƣ�Ũ�����ѻӷ������������ѻӷ����Σ��������D����a��ȷ��b��c����
��ѡ��a��
��7���ٵ������۱���ɫ����Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��Na2S2O3��Һʱ��Һ��ɫǡ����ȥ�Ұ�����ڲ���ԭ��˵������ζ��յ㣬
�ʴ�Ϊ���μ����һ��Na2S2O3��Һʱ����Һ��ɫǡ����ȥ�Ұ�����ڲ���ԭ��˵������ζ��յ㣻
������Ʒ��NaClO2�����ʵ���x����
NaClO2��2I2��4S2O32-��
1mol 4mol
0.25x c mol•L-1��V��10-3L
��x=c•V•10-3mol��
�ʴ�Ϊ��c•V•10-3��
���� ���⿼�����������Ʊ�ʵ��Ļ����������������Ƶ����ʼ��к͵ζ���֪ʶ������ԭ���ǽ���Ĺؼ���ͬʱ����ѧ���������⡢���������������ѵ�������ͼ�ķ�������Ŀ�Ѷ��еȣ�


 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����� | ʵ������ | ���� |
| A | ��Ũ��ˮ�ӵ�ʢ��AgCl������Թ��� | AgCl������ȫ�ܽ� | ������Һ��c��Ag+��•c��Cl-�� ��Ksp��AgCl�� |
| B | ��FeI2��Һ��ͨ������������������Ӧ�����Һ�еμ�KSCN��Һ | ��Һ��Ϊ��ɫ | Cl2�ܽ�Fe2+������Fe3+ |
| C | ����崿���еμ�����Ũ���ᣬ������������ͨ�뱽������Һ | ��Һ����� | ���ԣ����̼����� |
| D | �����ݵ�������Һ�зֱ�μӱ���NaCl��Һ��CuSO4��Һ | ���й������� | �����ʾ��������� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
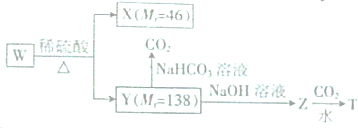
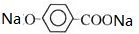 +CO2+H2O��
+CO2+H2O��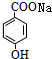 +NaHCO3��
+NaHCO3��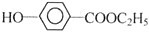
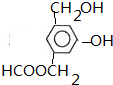 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
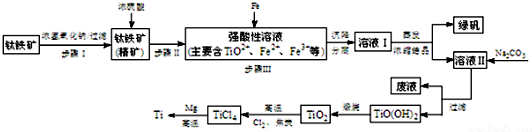
| pH | Fe��OH��3 | Fe��OH��2 | Mg��OH��2 | Ti��OH��2 |
| ��ʼ���� | 1.1 | 4.5 | 7 | 1 |
| ��ȫ���� | 2.8 | 6.4 | 9.2 | 2.7 |
| TiCl4 | Mg | MgCl2 | Ti | |
| �۵�/�� | -25.0 | 648.8 | 714 | 1667 |
| �е�/�� | 136.4 | 1090 | 1412 | 3287 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
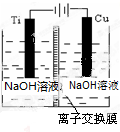 ����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����| ����a | ��̿���ڸ��������»�ԭCuO |
| ����b | �������ǻ�ԭ���Ƶ�Cu��OH��2�Ʊ�Cu2O |
| ����c | ��ⷨ����ӦΪ2Cu+H2O$\frac{\underline{\;���\;}}{\;}$Cu2O+H2�� |
| ����d | ���£�N2H4����ԭ���Ƶ�Cu��OH��2 |
| ��� | 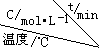 | 0 | 10 | 20 | 30 | 40 | 50 |
| �� | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| �� | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| �� | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ�� ��� | ���� ����/g | ���� ״̬ | c��H2SO4�� /mol•L-1 | V��H2SO4��/mL | ��Һ�¶�/�� | ������ʧ��ʱ��/S | |
| ��Ӧǰ | ��Ӧ�� | ||||||
| 1 | 0.10 | ˿ | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | ��ĩ | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | ˿ | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | ˿ | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | ��ĩ | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | ˿ | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | ˿ | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | ˿ | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | ˿ | 1.1 | 50 | 20 | 44 | 40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com