
分析 (1)0.224m3=224L,先计算气体的物质的量,进而根据1molCO燃烧放出热量283.0kJ计算放出的热量;
(2)水沸腾时温度达到100℃,从能量守恒的角度分析.
解答 解:(1)0.224m3=224L,n(CO)=$\frac{224L}{22.4L/mol}$=10mol,
完全燃烧放出的热量为:10mol×283.0kJ/mol=2830kJ,
答:释放出的热量是2830kJ.
(2)设上述CO燃烧时能使x千克25℃的水沸腾,
则有:2830kJ×80%=(100℃-25℃)×4kJ/kg×xkg,
解之得:x=7.2,
答:若热量损失20%,则上述CO燃烧时能使7.2千克25℃的水沸腾.
点评 本题考查反应热的计算,题目难度不大,注意相关物理量的计算,注重基础知识的积累,侧重于考查学生的分析能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 1mol乙烷中共价键总数为6NA | |
| B. | 1mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.1mol丙烯酸中含有双键的数目为0.2NA | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O=Ca(0H)2 | B. | C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用M表示此反应速率是0.1 amol•(L•min)-1 | |
| C. | 用X表示此反应的反应速率是(0.1-0.2 a)mol•(L•min)-1 | |
| D. | 当混合气体的压强不再发生变化时,说明反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
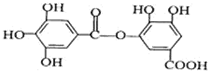 ,下列有关它的性质的叙述中,正确的是( )
,下列有关它的性质的叙述中,正确的是( )| A. | 有弱酸性,1 mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与6mol NaOH完全反应 | |
| C. | 在Ni催化下,1 mol 该物质可以和7mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com