
【题目】CO2与人们的日常生活、生产和科学研究密不可分,综合利用CO2是解决能源问题的有效途径之一。回答下列问题:
(1)用CaSO4代替O2与燃料CO反应,能得到较纯的CO2,有关反应如下:
①CaSO4(s)+4CO(g)=CaS(s)+4CO2(g) ΔH1=-189.2kJmol-1(主反应)
②CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5kJmol-1(副反应)
③CO(g)=![]() C(s)+
C(s)+![]() CO2(g) ΔH3=-86.2kJmol-1(副反应)
CO2(g) ΔH3=-86.2kJmol-1(副反应)
则反应2CaSO4(s)+7CO(g)=CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=___。
(2)已知CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH。向一密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)=0.2molL-1,c(H2)=0.8molL-1,c(H2O)=1.6molL-1。若200℃时该反应的平衡常数K=64.8,则该反应的ΔH___(填“>”或“<”)0。
(3)一定条件下,CO2还可以转化为低碳烯烃,反应的化学方程式为2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH,在两个容积均为2L的恒容密闭容器中以不同的氢碳比[![]() ]充入H2和CO2,CO2的平衡转化率α(CO2)与温度的关系如图所示。
]充入H2和CO2,CO2的平衡转化率α(CO2)与温度的关系如图所示。
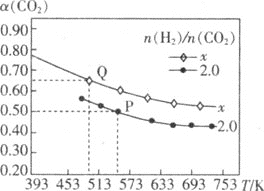
①x___(填“>”“<”或“=”)2.0。
②若起始加入的CO2、H2的物质的量分别为1mol和2mol,则P点时的平衡常数K=___。
③比较P点和Q点的化学平衡常数:Kp___(填“>”“<”或“=”)KQ,理由是___。
(4)据报道,以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示。

①a极发生___(填“氧化”或“还原”)反应。
②电解时,b极上生成乙烯的电极反应为___。
【答案】-151.1kJmol-1 < > 512 < 由图可知,该反应为放热反应,升高温度,化学平衡向左移动,K值减小,则KP<KQ 氧化 2CO2+12H++12e-=C2H4+4H2O
【解析】
(1)根据盖斯定律进行计算;
(2)根据300℃时反应达到平衡时各物质的浓度计算平衡常数;根据温度升高,平衡左移判定反应的H;
![]() 相同条件下,两种物质参加反应,增加该物质浓度,另外一种物质转化率增大;
相同条件下,两种物质参加反应,增加该物质浓度,另外一种物质转化率增大;
![]() 由图可知,P点的二氧化碳转化率为
由图可知,P点的二氧化碳转化率为![]() ,根据三段式进行平衡常数的计算;
,根据三段式进行平衡常数的计算;
![]() 由图可知,该反应为放热反应,升高温度,化学平衡向左移动,据此判断K值变化;
由图可知,该反应为放热反应,升高温度,化学平衡向左移动,据此判断K值变化;
![]() 电解池中,阳极发生氧化反应,由a极产生氧气可知,a极发生的是氧化反应;
电解池中,阳极发生氧化反应,由a极产生氧气可知,a极发生的是氧化反应;
![]() 极上生成乙烯为还原反应。
极上生成乙烯为还原反应。
![]() 由盖斯定律可可知,
由盖斯定律可可知,![]()
![]() 可得:2CaSO4(s)+7CO(g)=CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g) ΔH=-151.1kJmol-1;
可得:2CaSO4(s)+7CO(g)=CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g) ΔH=-151.1kJmol-1;
故答案为:-151.1kJmol-1;
(2)由在300℃时发生上述反应,达到平衡时测得c(CO2)=0.2molL-1,c(H2)=0.8molL-1,c(H2O)=1.6molL-1反应方程式和达到平衡时可知,平衡时c(CH4)=0.8molL-1,则300℃时,平衡常数为 ,若200℃时该反应的平衡常数
,若200℃时该反应的平衡常数![]() ,则说明温度升高,平衡逆向移动,该反应为放热反应,
,则说明温度升高,平衡逆向移动,该反应为放热反应,![]() ;
;
故答案为:![]() 。
。
![]() 相同条件下,氢气的物质的量浓度越大,二氧化碳的转化率越大,故
相同条件下,氢气的物质的量浓度越大,二氧化碳的转化率越大,故![]() ;
;
故答案为:![]() 。
。
![]() 由图可知,P点的二氧化碳转化率为
由图可知,P点的二氧化碳转化率为![]() ;
;
![]()
![]()
起始![]() : 1 2 0 0
: 1 2 0 0
变化![]() :
: ![]()
![]()
![]() 1
1
平衡![]() :
: ![]()
![]()
![]() 1
1
平衡![]() :
:![]()
![]()
![]()
![]()
平衡常数 ;
;
故答案为:512;
![]() 由图可知,该反应为放热反应,升高温度,化学平衡向左移动,K值减小,所以
由图可知,该反应为放热反应,升高温度,化学平衡向左移动,K值减小,所以![]() 。
。
故答案为:![]() ;由图可知,该反应为放热反应,升高温度,化学平衡向左移动,K值减小,则
;由图可知,该反应为放热反应,升高温度,化学平衡向左移动,K值减小,则![]() 。
。
![]() 由a极产生氧气可知,a极发生的是氧化反应;
由a极产生氧气可知,a极发生的是氧化反应;
故答案为:氧化;
![]() 极上生成乙烯的电极反应为
极上生成乙烯的电极反应为![]() ;
;
故答案为:![]() 。
。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】最近雾霾天气肆虐我国大部分地区。其中![]() 是造成空气污染的主要原因,利用钠碱循环法可除去
是造成空气污染的主要原因,利用钠碱循环法可除去![]() 。
。
![]() 钠碱循环法中,吸收液为
钠碱循环法中,吸收液为![]() 溶液中各离子浓度由大到小的顺序为_____________。
溶液中各离子浓度由大到小的顺序为_____________。
![]() 溶液吸收
溶液吸收![]() 反应的离子方程式是__________________________________。
反应的离子方程式是__________________________________。
![]() 已知
已知![]() 的电离常数为
的电离常数为![]() ,
,![]() ;
;![]() 的电离常数为
的电离常数为![]() ,
,![]() ,则下列微粒可以大量共存的是______
,则下列微粒可以大量共存的是______![]() 填序号
填序号![]() 。
。
A.![]() 和
和![]()
![]() 和
和![]()
![]() 和
和![]()
![]() 和
和![]()
![]() 吸收液吸收
吸收液吸收![]() 的过程中,水溶液中
的过程中,水溶液中![]() 、
、![]() 、
、![]() 随pH的分布如图:
随pH的分布如图:

![]() 吸收
吸收![]() 制备
制备![]() 溶液,实验中确定何时停止通
溶液,实验中确定何时停止通![]() 的实验操作为_________________。
的实验操作为_________________。
![]() 在
在![]() 溶液中离子浓度关系不正确的是_______
溶液中离子浓度关系不正确的是_______![]() 填序号
填序号![]() 。
。
A.![]()
![]()
C.![]()
![]()
![]() 亚硫酰氯
亚硫酰氯![]() 又名氯化亚砜,是一种液态的非电解质,沸点为
又名氯化亚砜,是一种液态的非电解质,沸点为![]() 。
。![]() 中氯元素与硫元素直接以共价键相连,其中Cl呈
中氯元素与硫元素直接以共价键相连,其中Cl呈![]() 价;
价;![]() 遇水可生成
遇水可生成![]() 。请回答下列问题:蒸干
。请回答下列问题:蒸干![]() 溶液不能得到无水
溶液不能得到无水![]() ,若将
,若将 ![]() 与
与![]() 混合并加热,可制得无水
混合并加热,可制得无水![]() ,请用
,请用 ![]() 与水反应的方程式和必要的文字描述解释原因________________________________________________________。
与水反应的方程式和必要的文字描述解释原因________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量SiO2、Fe的氧化物)为原料制备碳酸镁晶体(MgCO33H2O)。实验过程如下:

下列说法不正确的是( )
A.为了加快酸溶速率,可将原料进行研磨并适当提高反应温度
B.滤渣的主要成分是H2SiO3和SiO2
C.萃取后,可用KSCN溶液检验水相中是否含有Fe3+
D.萃取后,往水溶液中加入适量的Na2CO3,经过加热蒸发,可得到碳酸镁晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2molNO2的能量变化)。1molNO氧化为NO2的焓变ΔH=___。
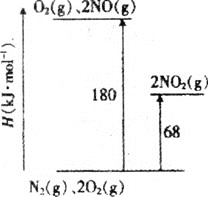
(2)某温度下,反应的平衡常数如下:
a.2NO2(g)N2(g)+2O2(g) K=6.7×1016
b.2NO(g)N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是___(填“a”或“b”);反应2NO(g)+O2(g)2NO2(g)的K=___(保留三位有效数字)。
(3)已知反应2NO(g)+O2(g)2NO2的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
起始浓度/molL-1 | |||
组别 | NO | O2 | 初始速率 /molL-1s-1 |
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0 0125 | 31.92×10-3 |
则k1=___,m=___,n=___。
(4)已知该反应的历程为:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列叙述正确的是___(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第一步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
(5)一定条件下测得容器中NO、O2、NO2浓度发生如图变化。
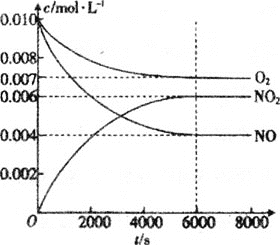
①NO的平衡转化率为___。
②该温度下反应2NO(g)+O2(g)2NO2(g)的平衡常数为___(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃复分解反应可形象地描述为交换舞伴(如图所示):

烯烃复分解反应中的催化剂是金属卡宾(如CH2=M),金属卡宾与烯烃分子相遇后,两对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻找下一个烯烃分子,再次“交换舞伴”。根据以上信息进行判断,如果把C6H5CH2CH=CH2与CH2=M在一定条件下混合反应,下列产物不可能存在的是 ( )
A. C6H5CH2CH=M B. CH2=CH2
C. C6H5CH2CH2C6H5 D. C6H5CH2CH=CHCH2C6H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J 是我国自主成功研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
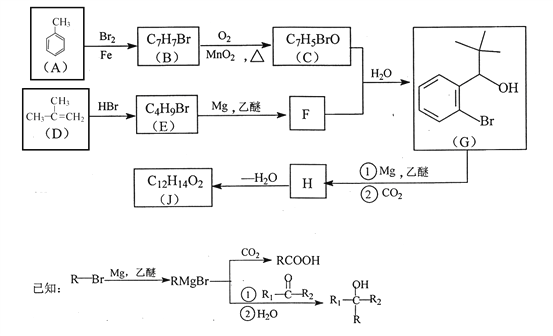
回答下列问题:
(1)B的结构简式是________________。C的结构简式是______________。
(2)D生成 E的化学方程式为_________________。
(3)J的结构简式是________________。在一定条件下,H自身缩聚生成高分子化合物的结构简式是_______________。
(4)根据![]() ,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无一O—O—键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以甲烷和甲苯 为原料,合成![]() 的路线流程图(其它试剂自选):____________________________。
的路线流程图(其它试剂自选):____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论正确的是( )
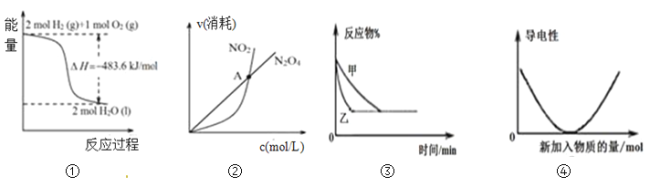
A.图①可知:热化学方程式是H2(g)+1/2O2(g)=H2O(g)△H=﹣241.8kJ/mol
B.图②可知:对于恒温恒容条件下的反应2NO2(g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C.图③可表示:压强对2A(g)+2B(g)![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
D.图④可表示:Ba(OH)2溶液中滴加稀硫酸,溶液导电性的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是a、b两种固体物质的溶解度曲线。下列说法中正确的是
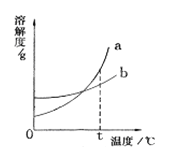
A. a物质的溶解度受温度变化的影响较小,b物质的溶解度受温度变化的影响较大。
B. t℃时,等质量的a、b饱和溶液中含有相同质量的溶质
C. 当温度大于t℃时,a溶液一定比b溶液浓
D. a中含有少量b时,用冷却热饱和溶液的方法提纯a。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
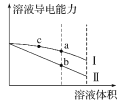
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com