
| A. | K+、Na+、MnO4-、SO42- | B. | OH-、K+、HCO3-、SO32- | ||
| C. | H+、Mg2+、Cl-、Br- | D. | Al3+、NH4+、OH-、NO3- |
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| C. | V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | V(NaOH)>10mL时,c(C2O42-)>c(Na+)>c(HC2O4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | 25 | ① | 2.0 | 4.0 | 4.0 | t2 |
| 3 | ② | 7.0 | 2.0 | 4.0 | 2.0 | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
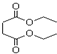
| A. | 1mol琥珀酸二乙酯能与4mol的NaOH反应 | |
| B. | 琥珀酸二乙酯在一定条件下能发生取代、加成和氧化反应 | |
| C. | 琥珀酸的分子式为C4H8O4 | |
| D. | 琥珀酸分子中含有六元环 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78 g Na2O2中存在的共价键总数为NA | |
| B. | 0.1 mol${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 氢氧燃料电池负极消耗2.24 L气体时,电路中转移的电子数为0.1NA | |
| D. | 0.1 mol氯化铁溶于1L水中,所得溶液中Fe3+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
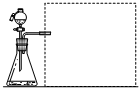
 某原电池的装置如图所示,看到a极上有红色金属析出,回答下列问题:
某原电池的装置如图所示,看到a极上有红色金属析出,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com