
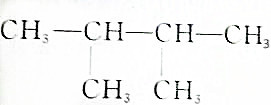
分析 同分异构体是指分子式相同,但结构不同的化合物,依据选项中结构简式命名、书写分子式,分析分子式相同的不同结构的为同分异构体;
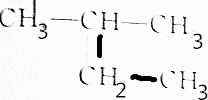
解答 解:①名称为2-甲基丁烷,分子式为C5H12;
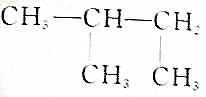
②新戊烷名称为2,2-二甲基丙烷,分子式为C5H12;
③名称为2-甲基丁烷,分子式为C5H12;
④有机物名称为2,3-二甲基丁烷,分子式为C6H14;
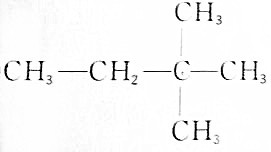
⑤有机物名称为2,2-二甲基丁烷,分子式为C6H14;
上述物质互为同分异构体的是①②、②③互为同分异构体,④⑤属于同分异构体,
故答案为:①②;②③;④⑤;
点评 本题考查同分异构体、物质的名称与化学式等,难度不大,注意化学式书写相同、名称相同的物质容易认为是同分异构体,为易错点.


科目:高中化学 来源: 题型:选择题
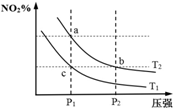 在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | 反应温度:T1>T2 | B. | b、c两点的反应速率:v(b)>v(c) | ||
| C. | a、c两点气体的颜色:a浅,c深 | D. | a、b两点的平衡常数:Kb>Ka |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g苯含有碳碳双键的数目为0.3NA | |
| B. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA | |
| C. | 1.6 g CH4含有共用电子对的数目为0.5NA | |
| D. | 100mLpH=2的新制氯水中,:N(OH-)+2N(ClO-)+N(HClO)=0.001NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,测得0.1 mol/L 的氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 向 NaAlO2溶液中通入过量CO2 制 Al(OH)3:CO2+AlO2-+2H20=HC03-+Al(OH)3↓ | |
| D. | 铅酸蓄电池在充电时的正极反应:PbO2+4H++SO42-+2e-═PbSO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com