
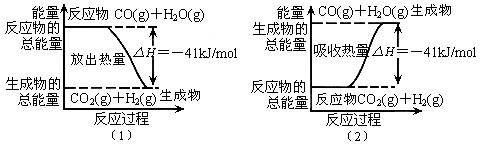
(1)________________________________(2)___________________________
科目:高中化学 来源: 题型:
 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已省略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已省略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.| 催化剂 |
| △ |
| 催化剂 |
| △ |

 或CH3-CH2=CH2+Br2--→CH3-CH2-CH2
或CH3-CH2=CH2+Br2--→CH3-CH2-CH2 或CH3-CH2=CH2+Br2--→CH3-CH2-CH2
或CH3-CH2=CH2+Br2--→CH3-CH2-CH2查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素代号 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期金属元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
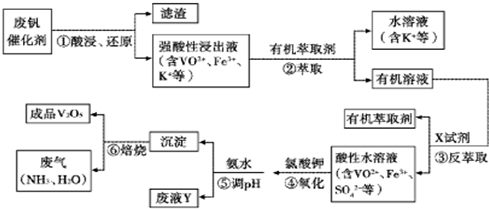
- 3 |
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钡沉淀率/% | 88 | 92 | 93 | 95 | 95 | 95 | 93 | 90 | 87 |
查看答案和解析>>
科目:高中化学 来源:安徽省淮北市第一中学2010届高三上学期第三次月考化学试题 题型:022
| |||||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com