
分析 (1)该反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,转移电子数为10;
(2)该反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,转移电子数为10,高锰酸钾是氧化剂、$\frac{5}{8}$的HCl作还原剂;
(3)同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(4)根据氯气和转移电子之间的关系式计算生成氯气体积;
(5)①根据各仪器的作用选取仪器;
②m(KMnO4)=CVM;
③根据c=$\frac{n}{V}$知,如果n偏小或V偏大都导致配制溶液浓度偏小;
(6)离子还原性Fe2+>Br-,首先发生:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕再发生:2Br-+Cl2═Br2+2Cl-,根据比例关系确定参加反应各离子物质的量关系,进而书写总的离子方程式.
解答 解:(1)该反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,转移电子数为10,则电子转移方向和数目为 ,故答案为:
,故答案为: ;
;
(2)该反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,转移电子数为10,高锰酸钾是氧化剂、$\frac{5}{8}$的HCl作还原剂,所以氧化剂和还原剂的物质的量之比=2:10=1:5,故答案为:1:5;
(3)同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,该反应中高锰酸钾是氧化剂、氯气是氧化产物,所以KMnO4的氧化性比Cl2的氧化性强,故答案为:强;
(4)每生成1mol氯气就转移2mol电子,则如反应中转移了2mol电子,生成1mol氯气,其标况下体积=1mol×22.4L/mol=22.4L,
故答案为:22.4L;
(5)①还需要配制溶液的100mL容量瓶、用于定容的胶头滴管,故答案为:100mL容量瓶;胶头滴管;
②m(KMnO4)=CVM=0.5mol/L×0.1L×158g/mol=7.9g,故答案为:7.9;
③根据c=$\frac{n}{V}$知,如果n偏小或V偏大都导致配制溶液浓度偏小,
A.加水定容时俯视刻度线,导致溶液体积偏小,配制溶液浓度偏大,故错误;
B.容量瓶内壁附有水珠而未干燥处理,溶液体积和溶质物质的量都不变,则配制溶液浓度不变,故错误;
C.颠倒摇匀后发现凹液面低于刻度线又加水补上,导致溶液体积偏大,配制溶液浓度偏小,故正确;
D.在溶解过程中有少量液体溅出烧杯外,溶质的物质的量偏小,配制溶液浓度偏小,故正确;
故选CD;
(6)离子还原性Fe2+>Br-,首先发生:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕再发生:2Br-+Cl2═Br2+2Cl-,①$\frac{a}{b}$=1,Fe2+全部被氧化,Br-是Fe2+的2倍,只有一半的Br-被氧化性,反应离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-;
②当$\frac{a}{b}$≥$\frac{3}{2}$时,Fe2+、Br-全部被氧化,反应离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;
故答案为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-;2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-.
点评 本题考查氧化还原反应计算、溶液配制、误差分析、氧化性强弱判断等知识点,为高频考点,侧重考查学生分析判断及计算能力,难点是(6)题离子方程式的书写,注意离子反应先后顺序,题目难度中等.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃发生反应生成CO2和H2并放出热量,CO和H2O浓度变化如图:
在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃发生反应生成CO2和H2并放出热量,CO和H2O浓度变化如图: CO2+H2
CO2+H2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 能导电 | 电解质 | 非电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ③⑤⑥⑨⑩ | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3做发酵粉时加入柠檬酸后效果更好 | |
| B. | CaCO3的饱和溶液pH约为9.3 | |
| C. | 0.1 mol/L AlCl3溶液中c(Al3+)<0.1 mol/L | |
| D. | 加热氯化铁溶液的颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

 ②
② ③
③ ④
④ ⑤
⑤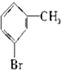
 ⑦
⑦
| A. | ①②③ | B. | ⑦ | C. | ④⑤⑥⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 43:7 | B. | 18:7 | C. | 4:1 | D. | 22:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com