
分析 (1)写出反应方程式,注明物质的聚集状态,依据反应物用量与反应放出热量写出热化学方程式;
(2)根据热化学方程式的书写原则写出热化学方程式,方程中的热量和化学计量数要对应;
(3)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成CO2和液态水时放热22.68kJ×32=725.76kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热725.76KJ,根据燃烧热的概念分析即可解答.
解答 解:(1)卫星发射时可用肼(N2H4)做燃料,1mol N2H4(L)在氧气(g)中燃烧,生成氮气(g)和水(l),放出622KJ热量,反应的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622 kJ/mol;
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622 kJ/mol;
(2)10gC2H6(l)在与O2(g)中燃烧,生成CO2(g)和H2O(l),放出akJ热量,则1molC2H6(l)在与O2(g)中燃烧,生成CO2(g)和H2O(l),放出热量为
$\frac{a}{10}$×30=3aKJ,该反应的热化学方程式为C2H6(l)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=-3akJ/mol,
故答案为:C2H6(l)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=-3akJ/mol;
(3)1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ,燃烧热热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用,题目较简单.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 25mL | B. | 250mL | C. | 50mL | D. | 500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
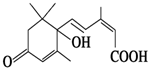 北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开.S诱抗素的分子结构如图,根据S诱抗素结构,可知S诱抗素分子中含有的官能团有羰基、碳碳双键、羟基、羧基.
北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开.S诱抗素的分子结构如图,根据S诱抗素结构,可知S诱抗素分子中含有的官能团有羰基、碳碳双键、羟基、羧基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol锌粒与足量盐酸反应产生11.2 L H2 | |
| B. | 标准状况下,18g的H2O中含有的电子数为10NA | |
| C. | 常温常压下,11.2L氧气所含的原子数为NA | |
| D. | 2.4g金属镁变为镁离子失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4电离方程式H2SO4=2H++S6++4O2- | |
| B. | H2、D2、T2互为同位素 | |
| C. | 18g H2O含有的电子数为10NA | |
| D. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的核外电子数和中子数均为62 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com