
| A. | 实验室用KClO3制取氧气所剩余的KCl和MnO2的混合物 | |
| B. | 实验室用稀盐酸和大理石反应制取CO2时,得到的CaCl2和大理石的混合物 | |
| C. | 某同学用氢气还原氧化铜来制取纯净的铜,由于最后操作不当而使还原生成的铜部分被氧化后剩余的混合物 | |
| D. | 用过量的Zn粉和稀H2SO4溶液来制取H2最后剩余的混合物 |
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极的反应式是:PbO2+SO42-+4H++2e-═PbSO4+2H2O | |
| B. | 放电时,电解质溶液中的H+向负极移动 | |
| C. | 充电时,阳极的电极反应为:PbSO4+2e-═Pb(s)+SO42- | |
| D. | 充电时,当有20.7gPb生成时,转移的电子为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |  |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 8:7 | B. | 2:7 | C. | 1:1 | D. | 1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b(1-a)}{7}$ | B. | $\frac{1-a}{7}$ | C. | $\frac{a}{8}$ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 常温常压下,32gO2和32gO3所含氧原子数都是NA | |
| C. | 1molFe与足量盐酸反应,转移电子数为3NA | |
| D. | 标准状况下36g H2O中原子的数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOC2H5+H2O
CH3COOC2H5+H2O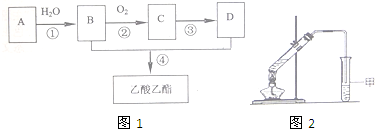
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com