
| A. | 等于7 | B. | 大于7 | C. | 小于7 | D. | 无法确定 |
科目:高中化学 来源: 题型:解答题
 制取 聚苯乙烯
制取 聚苯乙烯 .
. +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 | |
| B. | 若丙、丁混合产生白烟,且丙为18电子分子,则乙的水溶液可能具有漂白作用 | |
| C. | 若甲、丙、戊含有同一种元素,该元素的化合价由低到高的顺序可能为甲<丙<戊 | |
| D. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压同体积的气体单质所含原子个数相等 | |
| B. | 常温常压下,11.2LO2所含的氧原子数为NA | |
| C. | 摩尔是沟通宏观和微观的桥梁 | |
| D. | 大规模海水淡化采用蒸馏法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可用丁达尔效应鉴别胶体与溶液 | |
| B. | “雨后彩虹”既是一种自然现象又是光学现象,同时也与胶体有关 | |
| C. | 在溶有1mol Fe(OH)3的胶体中,含有NA个Fe(OH)3胶粒 | |
| D. | 分散质粒子大小介于1~100nm之间的分散系称为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
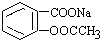 转变为
转变为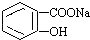 的方法是( )
的方法是( )| A. | 与足量Na0H溶液共热后,再通入CO2 | |
| B. | 溶液加热,通入足量的SO2 | |
| C. | 与稀硫酸共热后,加入足量Na0H溶液 | |
| D. | 足量稀硫酸共热后,加入足量NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸发皿中放入NaCl溶液,加热、蒸发所有水分得到NaCl晶体 | |
| B. | 用10 mL的量筒量取5.2 mL的盐酸 | |
| C. | 用托盘天平称取25.20 g NaCl | |
| D. | 用1 000 mL容量瓶配制450 mL 0.1 mol•L-1的盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com