

分析 要探究钠能否在二氧化碳中燃烧,首先要制取纯净的二氧化碳,A装置:制取二氧化碳,需除掉二氧化碳中混有的氯化氢气体、水;B装置:在除氯化氢气体时,不能用氢氧化钠溶液,因为氢氧化钠会和二氧化碳反应;C装置:在除水时可以用浓硫酸作干燥剂;在点燃d装置中的酒精灯前,必须除去系统内的空气,防止钠与空气中的氧气反应;通过对生成物进行了探究实验可得出钠与二氧化碳反应生成了碳酸钠和碳.
(1)石灰石和盐酸反应制取二氧化碳,盐酸易挥发,装置B的作用是除去二氧化碳中的氯化氢气体,碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳,浓硫酸的作用干燥CO2气体(或除水蒸气);
(2)用酒精灯在试管D底部加热,钠在充满二氧化碳气体的试管里剧烈地燃烧,产生大量的白烟溶解于水加澄清石灰水,溶液变浑浊.再滴入稀盐酸,溶液中有气泡出现为Na2CO3,黑色物质不溶为C;
(3)上述实验中所得3.0g黑色物质为碳,根据4Na+3CO2$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+C、2Na+2H2O=2NaOH+H2↑计算标况下气体的体积.
解答 解:(1)装置B的作用是除去氯化氢气体;在除氯化氢气体时,不能用氢氧化钠溶液,因为氢氧化钠会和二氧化碳反应,需用饱和碳酸氢钠来吸收氯化氢反应为:NaHCO3+HCl═NaCl+H2O+CO2↑,浓硫酸具有吸水性,可以用浓硫酸做干燥剂来吸收水,
故答案为:NaHCO3+HCl═NaCl+H2O+CO2↑;干燥CO2气体(或除水蒸气);
(2)白色物质滴入稀盐酸,溶液中有气泡出现,应为Na2CO3,将滤纸上的黑色物质干燥,点燃,其燃烧产物无色无味且能使澄清石灰水变浑浊,则玻璃管中的黑色物质是碳,涉及反应为4Na+3CO2$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+C,
故答案为:Na2CO3;C(碳);4Na+3CO2$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+C;
(3)上述实验中所得3.0g黑色物质为碳,n(C)=$\frac{3g}{12g/mol}$=0.25mol,由4Na+3CO2$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+C可知:n(Na)=4×0.25mol=1mol,由2Na+2H2O=2NaOH+H2↑可知:
可得到标况下气体的体积为0.5mol×22.4L/mol=11.2L,
故答案为:11.2L.
点评 本题考查于性质实验方案的设计和探究,侧重于钠及其化合物基础知识的考查,注意把握实验原理和物质的性质,为解答该题的关键,答题时注意题给信息和反应现象,注意仔细审题,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) | |
| C. | 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol气体Y,到达平衡时,n(Z)=0.24 mol | |
| D. | 其他条件不变,向平衡体系中再充入0.16 mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,F中的含氧官能团名称酚羟基、羧基;
,F中的含氧官能团名称酚羟基、羧基; ;
; +O2$\stackrel{Cu}{→}$2
+O2$\stackrel{Cu}{→}$2 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25mL | B. | 250mL | C. | 50mL | D. | 500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
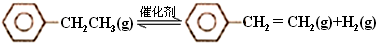
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
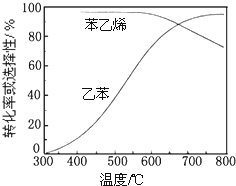
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
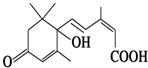 北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开.S诱抗素的分子结构如图,根据S诱抗素结构,可知S诱抗素分子中含有的官能团有羰基、碳碳双键、羟基、羧基.
北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开.S诱抗素的分子结构如图,根据S诱抗素结构,可知S诱抗素分子中含有的官能团有羰基、碳碳双键、羟基、羧基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
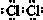 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com