
 如图为氢氧燃料电池装置示意图.
如图为氢氧燃料电池装置示意图.分析 氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的电极是负极,氧气易得电子发生还原反应,所以通入氧气的电极是正极;
当电解质溶液是氢氧化钾时,负极上氢气失电子和氢氧根离子反应生成水,正极上氧气得电子生成氢氧根离子;当电解质溶液是酸时,负极上氢气生成氢离子,正极上氧气和氢离子反应生成水,据此分析解答.
解答 解:(1)因为2H2+O2═2H2O 为氧化还原反应,并且反应放热,所以该反应能设计成原电池,
故答案为:该反应属于氧化还原反应,并且反应放热;
(2)氢氧燃料电池中,氧气中氧元素化合价为0,降低为H2O中的-2价,得电子,做正极反应物,所以通入氧气的电极是正极,
故答案为:氧气;氧气中氧元素化合价为0,降低为H2O中的-2价,得电子,做正极反应物;
(3)a.电子由负极沿导线转移到正极,所以导线是电子导体,故正确;
b.氢氧燃料电池装置不需要条件就能产生电流,故错误;
c.负极Pt电极失电子,正极Pt电极得电子,所以Pt电极主要作用是提供得失电子的场所,故正确;
d.电子从通氢气气的负极沿导线转移到通氧气的正级,故错误;
故选:b、d;
(4)氢氧燃料电池中氢气在负极上失去电子生成氢离子,电子沿导电流向正极,氧气在正极上得到电子生成氢氧根离子,氢氧化钾溶液传导离子,形成闭合回路,形成电流,
故答案为:氢气在负极上失去电子生成氢离子,电子沿导电流向正极,氧气在正极上得到电子生成氢氧根离子,氢氧化钾溶液传导离子,形成闭合回路,形成电流.
点评 本题考查了燃料电池,正负极的判断以及原电池原理,难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
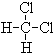 和
和 ; ⑦CH3 (CH2) 3CH3和
; ⑦CH3 (CH2) 3CH3和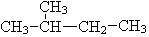
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下能溶于水 | B. | 水溶液能导电 | C. | 熔融状态能导电 | D. | 具有较高的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ZM2分子中各原子的最外层均满足8电子稳定结构 | |
| B. | 离子半径:M->Z2->Y- | |
| C. | 电负性:Y>Z>M | |
| D. | Z元素基态原子最外层电子排布图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
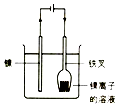 | 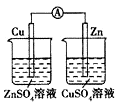 |  |  |
| 铁叉镀镍 | 组成原电池并产生明显电流 | 电解法制铝 | 准确量取一定体积K2Cr2O7标准溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇分子中含有极性键的数目为6NA | |
| B. | 分子数为NA的CO、C2H4混合气体体积为22.4L,质量为28g | |
| C. | $\frac{1}{18}$mol的H35Cl分子所含中子数为NA | |
| D. | 加热条件下,1molH2与1molI2混合,该反应过程中转移的电子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com