
【题目】如图所示是一个制取氯气并以氯气为原料进行特定反应的装置,多余的氯气可以贮存在b瓶中,其中各试剂瓶中所装试剂为:C(氯化亚铁溶液)、D(碘化钾淀粉溶液)、E(紫色石蕊试液)、G(含酚酞的氢氧化钠溶液)

(1)A是氯气的发生装置,反应的离子方程式为________________________。
(2)a仪器的名称为_________________,B中宜加入的液体是_________________。
(3)实验开始后C中反应的离子方程式是________________________________,D中的现象是___________________,E中的现象是____________________________。
(4)F装置中硬质玻璃管内盛有炭粉,若F中发生氧化还原反应,其产物为二氧化碳和氯化氢,则F中反应的化学方程式为___________________________________________。
(5)G中发生氧化还原反应的离子方程式为________________________________。
(6)F处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,则装置B中的现象是____________________________;若发现装置B中该现象不明显,可能的原因是A或B装置漏气,查找原因时若用蘸有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程式_____________________________。
【答案】MnO2+4H++2Cl-(浓)![]() Mn2++Cl2↑+2H2O 圆底烧瓶 饱和食盐水 2Fe2++Cl2=2Fe3++2Cl- 溶液变蓝 由紫色变为红色,再变为无色 2Cl2+C+2H2O
Mn2++Cl2↑+2H2O 圆底烧瓶 饱和食盐水 2Fe2++Cl2=2Fe3++2Cl- 溶液变蓝 由紫色变为红色,再变为无色 2Cl2+C+2H2O ![]() 4HCl+CO2 Cl2+2OH-=Cl-+ClO-+H2O 装置B中瓶内液面下降,长颈漏斗中液面上升 3Cl2+8NH3=N2+6NH4Cl
4HCl+CO2 Cl2+2OH-=Cl-+ClO-+H2O 装置B中瓶内液面下降,长颈漏斗中液面上升 3Cl2+8NH3=N2+6NH4Cl
【解析】
A中浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,b瓶是用来贮存Cl2的,则应选用一种Cl2在其中溶解度非常小的液体,一般选用饱和食盐水。实验开始后,Cl2可与C中氯化亚铁反应得到三价铁离子,Cl2从D中置换出单质碘从而使D中溶液变蓝色,E中紫色石蕊试液先变红后褪色,G用来吸收多余的氯气。
(1)浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,反应的离子方程式为MnO2+4H++2Cl-(浓)![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)仪器a为圆底烧瓶;B中试剂应选用一种Cl2在其中溶解度非常小的液体,一般选用饱和食盐水。
(3)Cl2可与C中的氯化亚铁发生氧化还原反应:2Fe2++Cl2=2Fe3++2Cl-;Cl2从D中置换出单质碘从而使D中溶液变蓝色;氯气溶于水显酸性,并生成具有漂白性的次氯酸,故E中溶液由紫色变为红色,再变为无色。
(4)F装置中硬质玻璃管内盛有炭粉,若F中发生氧化还原反应,其产物为二氧化碳和氯化氢,反应方程式为Cl2+C+2H2O ![]() 4HCl+CO2。
4HCl+CO2。
(5)G中氢氧化钠与剩余的氯气发生反应,得到次氯酸钠、氯化钠和水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
(6)F处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,导致A中压强大于B,使装置B中瓶内液面下降,长颈漏斗中液面上升;查找原因时浓氨水挥发出的氨气与泄露的氯气反应生成氯化铵,化学方程式为3Cl2+8NH3=N2+6NH4Cl。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】在恒温、体积为2 L的密闭容器中进行反应:2A(g) ![]() 3B(g)+C(g),若反应物在前20 s由3 mol降为1.8 mol,则前20 s的平均反应速率为
3B(g)+C(g),若反应物在前20 s由3 mol降为1.8 mol,则前20 s的平均反应速率为
A. v(B)=0.03 mol·L-1·s-1 B. v(B)=0.045 mol·L-1·s-1
C. v(C)=0.03 mol·L-1·s-1 D. v(C)=0.06 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____。
②与BH4-互为等电子体的阳离子的化学式为_____。
③H、B、Ti原子的第一电离能由小到大的顺序为_____。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
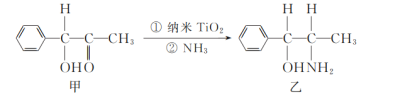
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____。
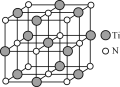
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是s能级和p能级的电子云轮廓图,试回答问题。


(1)s电子云轮廓图呈________形,每个s能级有________个原子轨道;p电子云轮廓图呈________状,每个p能级有________个原子轨道,其能量关系为____________(填“相同”或“不相同”)。
(2)元素X的原子最外层的电子排布式为nsnpn+1,原子中能量最高的是________电子;元素X的名称是____,它的氢化物的电子式是________。
(3)若元素Y的原子最外层的电子排布式为nsn-1npn+1,那么Y的元素符号应为________,原子的电子排布图为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大。)请回答下列问题:

实验Ⅰ:制备BCl3并验证产物CO
(1)该实验装置中合理的连接顺序为G→___→___→__→__→F→D→I;其中装置E的作用是______。
(2)BCl3接触潮湿空气时会形成白雾,请写出该反应的化学方程式____。
(3)能证明反应中有CO生成的现象是_____。
实验Ⅱ:产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2mL。
已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤②移取溶液时所需仪器名称为____,步骤④中达到滴定终点的现象为_____。
(5)产品中氯元素的质量分数为_______。
(6)下列操作,可能引起测得产品中氯含量偏高是_____。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为-5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
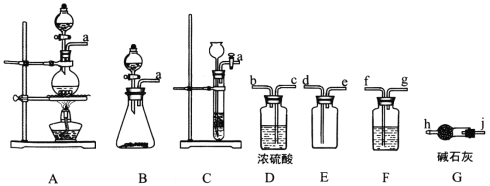
(1)制备Cl2的发生装置可以选用___________(填字母代号)装置,发生反应的离子方程式为___________。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→________________(按气流方向,用小写字母表示)。
(3)实验室可用图示装置制备亚硝酰氯:
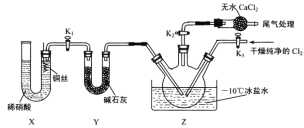
①实验室也可用 B 装置制备 NO , X装置的优点为___________________________________。
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是____________,然后进行其他操作,当Z中有一定量液体生成时,停止实验。
(4)已知:ClNO 与H2O反应生成HNO2和 HCl。
①设计实验证明 HNO2是弱酸:_____________。(仅提供的试剂:1 molL-1盐酸、 1 molL-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是__________,亚硝酰氯(ClNO)的质量分数为_________。(已知: Ag2CrO4为砖红色固体; Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求作答:
(1)泡沫灭火剂中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂,写出使用时发生反应的离子方程式____________________________
(2)写出难溶电解质Mg(OH)2的溶度积表达式: Ksp=________;在Mg(OH)2悬浊液中加入FeCl3固体充分振荡后静置,发生沉淀的转化过程可用离子方程式表示为________。
(3)通过煤的干馏可以获得化工原料苯。苯与浓硝酸在催化剂条件下进行反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡贝地尔(  )是多巴胺能激动剂,合成路线如下:
)是多巴胺能激动剂,合成路线如下:
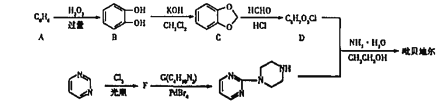
已知:①![]()
②D的结构简式为![]()
(1)A的名称是__________。
(2)E→F的反应类型是__________。
(3)G的结构简式为________;1molB最多消耗NaOH与Na的物质的量之比为_______。
(4)D+H→吡贝地尔的反应的化学方程式为_______。
(5)D的同分异构体中满足下列条件的有______种(碳碳双键上的碳原子不能连羟基),其中核磁共振氢谱有5种峰且峰面积之比为2:2:1:1:1的结构简式为_______(写出一种即可)。①与FeCl3溶液发生显色反应②苯环上有3个取代基③1mol该同分异构体最多消耗3molNaOH。
(6)已知:![]() ;参照上述合成路线,以苯和硝基苯为原料(无机试剂任选)合成
;参照上述合成路线,以苯和硝基苯为原料(无机试剂任选)合成![]() ,设计制备的合成路线:_______。
,设计制备的合成路线:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com