
| A、0.01mol/L CH3COOH |
| B、0.01mol/L HNO3 |
| C、pH=2的H2SO4溶液 |
| D、pH=2的CH3COOH溶液 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (1)已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为
(1)已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24L CO2中含有的原子数为0.3NA |
| B、0.1mol F-中含有的电子数等于0.9NA |
| C、5.6g铁粉与氯气反应失去的电子数为0.2NA |
| D、电解饱和食盐水若产生2g氢气,则转移的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离常数 | Ka1 | Ka2 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
| H2S | 5.7×10-8 | 1.2×10-15 |
| A、NaHCO3+NaHS=Na2CO3+H2S反应可能发生 |
| B、H2S+Na2CO3=NaHS+NaHCO3反应不可能发生 |
| C、将Na2S溶液适当加热(忽略水的蒸发),溶液中阴离子数目会增多 |
| D、Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
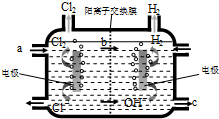
 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用NnO2,其工作原理如下图所示.下列说法错误的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用NnO2,其工作原理如下图所示.下列说法错误的是( )| A、电池放电时Na+从a极区移向b极区 |
| B、电极b采用MnO2,MnO2既作电极材料,又有催化作用 |
| C、每消耗3mo1H2O2,转移的电子为3mo1 |
| D、该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
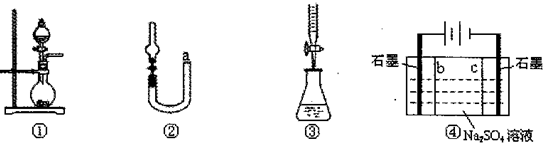
| A、装置①可用于实验室制取少量NH3或O2 |
| B、可用从a处加水的方法检验装置②的气密性 |
| C、利用装置③实现NaOH溶液滴定盐酸 |
| D、利用装置④制硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时覆盖PbO2的电极为正极,发生还原反应 |
| B、放电时电解质溶液中的H+向正极移动 |
| C、充电时阴极的电极反应为 PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
| D、充电时电解质溶液的pH逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢: Mg>Al>Fe | 反应物的性质越活泼, 反应速率越快. |
 (1)该同学的实验目的是
(1)该同学的实验目的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
| B、可用稀硫酸鉴别亚硝酸钠和食盐 |
| C、减压过滤不宜用于过滤胶状或颗粒太小的沉淀 |
| D、变色硅胶干燥剂含有CoCl2,干燥剂呈蓝色时,表示具有吸水干燥功能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com