
【题目】铬及其化合物在工农业生产中具有广泛应用,请回答下列问题:
(1)基态铬原子的核外电子排布式为_____________。
(2)Cr3+能形成配离子[Cr(H2O)(H2NCH2CH2NH2)]3+,在配体H2NCH2CH2NH2 中采用 sp3杂化的原子有_____。
(3)氯化铬酰(CrO2Cl2)熔点:-96.5℃,沸点:117℃,能与 CS2 等互溶.则固态 CrO2Cl2属于________晶体。已知 NO2+与 CS2 互为等电子体,则 1molNO2+中含有π键数目为 ____________
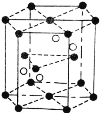
(4)Cr2O3 晶胞结构如图所示,已知 Cr2O3 的摩尔质量为 M g/mol,晶体的密度为ρ g·cm-3 ,晶胞体积为 V cm3. 晶胞结构示意图中的小黑球代表_____(填“铬离子”或“氧离子”),阿伏加德罗常数NA=_________mol-1(用含 M, V, ρ的代数式表示 )。
【答案】[Ar]3d54s1 C、N 分子 2NA 氧离子 ![]()
【解析】
(1)Cr为24号元素,其原子核外有24个电子,根据构造原理书写基态铬原子的核外电子排布式;
(2)在配体H2NCH2CH2NH2中采用sp3杂化的原子价层电子对个数是4;
(3)分子晶体熔沸点较低;NO2+与CS2互为等电子体,等电子体结构相似,二硫化碳分子中含有2个π键,则1个NO2+中含有π键数目为2;
(4)该晶胞中黑色球个数=12×![]() +2×
+2×![]() +3=6、白色球个数为4,则黑色球、白色球个数之比=6:4=3:2,其化学式为Cr2O3,据此判断黑色球代表离子;根据晶体密度ρ=
+3=6、白色球个数为4,则黑色球、白色球个数之比=6:4=3:2,其化学式为Cr2O3,据此判断黑色球代表离子;根据晶体密度ρ=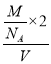 计算NA。
计算NA。
(1)Cr为24号元素,其原子核外有24个电子,根据构造原理书写基态铬原子的核外电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1;
(2)在配体H2NCH2CH2NH2中采用sp3杂化的原子价层电子对个数是4,C、D原子价层电子对个数都是4,所以采用sp3杂化的原子有C、N;
(3)分子晶体熔沸点较低,该物质熔沸点较低,为分子晶体;NO2+与CS2互为等电子体,等电子体结构相似,二硫化碳分子中含有2个π键,则1个NO2+中含有π键数目为2,所以1molNO2+中含有π键数目为2NA;
(4)该晶胞中黑色球个数=12×![]() +2×
+2×![]() +3=6、白色球个数为4,则黑色球、白色球个数之比=6:4=3:2,其化学式为Cr2O3,据此判断黑色球代表离子为氧离子;根据晶体密度ρ=
+3=6、白色球个数为4,则黑色球、白色球个数之比=6:4=3:2,其化学式为Cr2O3,据此判断黑色球代表离子为氧离子;根据晶体密度ρ=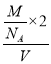 得NA=
得NA=![]() /mol。
/mol。


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C三种试剂,按图中的实验步骤进行操作:
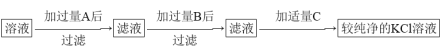
(1)B的化学式_________。
(2)加过量A的原因是________,有关反应的化学方程式为__________;____________。
(3)加过量B的原因是____________,有关反应的化学方程式为________;_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
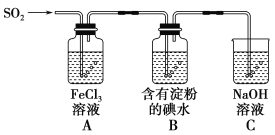
(1)SO2气体和Fe3+反应的氧化产物、还原产物分别是________、________
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4共热
(3)装置C的作用是__________________________________________________。
(4)装置B中反应的离子方程式_________________________________________________。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是方案_____,原因是__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。
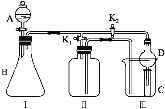
(1)打开K1关闭K2,可制取某些气体。甲同学认为装置Ⅰ可用于制取H2、NH3、O2,但装置Ⅱ只能收集H2、NH3,不能收集O2。其理由是_____。乙同学认为在不改动装置Ⅱ仪器的前提下,对装置Ⅱ进行适当改进,也可收集O2。你认为他的改进方法是_____。
(2)打开K2关闭K1,能比较一些物质的性质。丙同学设计实验比较氧化性:KClO3>Cl2>Br2。在A中加浓盐酸后一段时间,观察到C中的现象是______;仪器D在该装置中的作用是_______。在B装置中发生反应的离子方程式为______。丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是_____。
(3)实验室常用浓H2SO4与硝酸钠反应制取HNO3。下列装置中最适合制取HNO3的是_____。实验室里贮存浓硝酸的方法是_______。
a 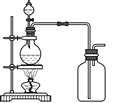 b
b 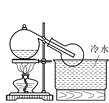 c
c 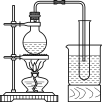 d
d 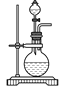
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化如图所示(忽略温度变化),已知:常温下,H2X的电离常数Ka1=1.1×10-5,Ka2=1.3×10-8。下列叙述正确的是
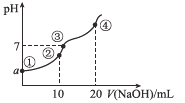
A.a近似等于3
B.点②处c(Na+)+2c(H+)+c(H2X)=2c(X2-)+c(HX-)+2c(OH-)
C.点③处为H2X和NaOH中和反应的滴定终点
D.点④处c(Na+)=2c(X2-)>c(OH-)>c(HX-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。下列说法正确的是
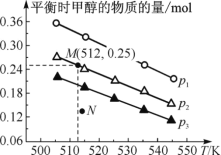
A. 该反应的正反应为放热反应
B. 压强大小关系:p1<p2<p3
C. M点对应的平衡常数K的值约为 1.04×10-2
D. 在p2及512 K时,图中N点v(正)<v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com