
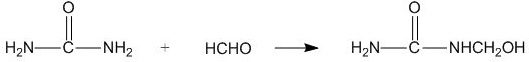
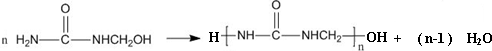
| A. | 合成脲醛塑料的反应为加聚反应 | |
| B. | 尿素与氰酸铵 ( NH4CNO ) 互为同系物 | |
| C. | 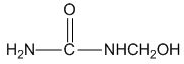 能发生水解反应 能发生水解反应 | |
| D. | 脲醛塑料平均相对分子质量为10000,平均聚合度为111 |
分析 A.由 可知,有小分子生成;
可知,有小分子生成;
B.尿素与氰酸铵 ( NH4CNO )分子式相同,结构不同;
C. 中含-CONH-键;
中含-CONH-键;
D.链节为-NHCONHCH2-,其相对分子质量为72.
解答 解:A.由 可知,有小分子生成,为缩聚反应,故A错误;
可知,有小分子生成,为缩聚反应,故A错误;
B.尿素与氰酸铵 ( NH4CNO )分子式相同,结构不同,二者互为同分异构体,故B错误;
C. 中含-CONH-键,可发生水解反应,故C正确;
中含-CONH-键,可发生水解反应,故C正确;
D.链节为-NHCONHCH2-,其相对分子质量为72,平均聚合度为$\frac{10000}{72}$=138,故D错误;
故选C.
点评 本题考查有机物的合成及性质,为高频考点,把握发生的合成反应、有机物结构与性质为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+ Na+ AlO2- Cl- | B. | K+ Na+ Cl- CO32- | ||
| C. | Fe3+ Na+ Cl- HCO3- | D. | SO42- Fe2+ H+ NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图| A. | 在400℃时,反应①未达平衡,反应②达到平衡 | |
| B. | 800℃后再升高温度,反应①的平衡逆向移动;反应②的平衡正向移动 | |
| C. | 加压可提高NH3生成NO的转化率 | |
| D. | N2氧化为NO的热化学方程式为:N2(g)+O2(g)?2NO(g)△H=-181.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

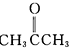 ”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是
”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是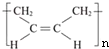 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
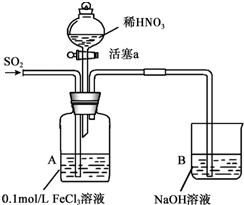 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a. | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中注入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
 Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解. Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫具有漂白性,能使氯水褪色 | |
| B. | 浓硫酸具有较强酸性,能使Cu转化为Cu2+ | |
| C. | 硅具有还原性,一定条件下能将铁从其氧化物中置换出来 | |
| D. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/L Na2C2O4中:2c(Na+)═c(C2O42- )+c(HC2O4-)+c(H2C2O4) | |
| B. | 浓度均为0.1mol/L的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)═2c(CO32-)+c(OH-)+c〔HCO3-) | |
| C. | 向10mL pH=l2的NaOH溶液中滴加等体积pH=2的CH3COOH:c(CH3COO-)>c(Na+)>c(OH-)>C(H+) | |
| D. | 0.2mol/L NaHCO3与0.1mol/L KOH溶液等体积混合:c(Na+)═2c(CO32-)+c〔HCO3-)+c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com