
| A. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1; | |
| B. | C(石墨,s)=C(金刚石,s)△H=-1.9 kJ•mol-1; | |
| C. | C(石墨,s)=C(金刚石,s)△H=-788.92 kJ•mol-1; | |
| D. | C(石墨,s)=C(金刚石,s)△H=+788.92 kJ•mol-1; |
分析 已知①C(金刚石,s)+O2(g)=CO2(g)△H=-395.41 kJ•mol-1;②C(石墨,s)+O2(g)=CO2(g)△H=-393.51 kJ•mol-1,根据盖斯定律②-①可得:C(石墨,s)=C(金刚石,s),据此计算出石墨转化成金刚石的焓变即可.
解答 解:①C(金刚石,s)+O2(g)=CO2(g)△H=-395.41 kJ•mol-1;
②C(石墨,s)+O2(g)=CO2(g)△H=-393.51 kJ•mol-1,
根据盖斯定律②-①可得:C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1,
故选A.
点评 本题考查了盖斯定律的应用,题目难度不大,明确盖斯定律的内容及应用方法为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:填空题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | |||||||
| 3 | A | C | D | G | ||||
| 4 | B | F |
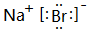 ,高温灼烧该化合物时,火焰呈黄色.
,高温灼烧该化合物时,火焰呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.22 mol/L | B. | 0.11 mol/L | C. | 0.022 mol/L | D. | 0.011 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为BH4-+8OH--8e-=BO2- | |
| C. | b极上的电极反应式为H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
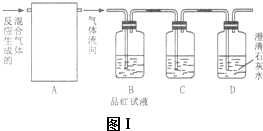
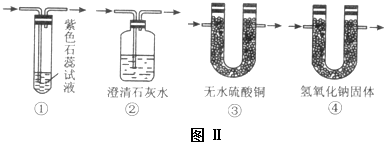
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | |||
| 1 | 20 | 1.02 | 21.03 | |
| 2 | 20 | 2.00 | 25.00 | |
| 3 | 20 | 0.60 | 20.60 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com