
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间。以下叙述正确的是( )

A. 两烧杯中铜片表面均有气泡产生
B. 甲烧杯中的电流与阳离子流向均为Zn→Cu
C. 两烧杯中溶液的pH均增大
D. 两烧杯在相同时间内转移电子数相等
【答案】C
【解析】
试题甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析。
A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B、甲烧杯中的电流流向均为Cu→Zn,故B错误;
C、甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,因此pH均增大,故C正确.
D、甲装置形成了原电池,反应速率会加快,因此甲比乙在相同时间内转移的电子数要多,故D错误.
故选C。


科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是:
①需要加热才能发生的反应一定是吸热反应;②放热反应在常温下一定很容易发生;③一个化学反应是放热反应还是吸热反应,必须看反应物和生成物所具有的总能量的相对大小;④有的吸热反应在常温下也能发生。
A.①②③④B.①②C.②③④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度压强下,用mg的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )
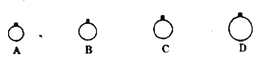
A.气球B中装的是O2
B.气球A和气球C中气体分子数相等
C.气球A和气球D中气体物质的量之比为4:1
D.气球C和气球D中气体密度之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用SO2与Cl2在活性炭的催化下制取一种重要的有机合成试剂磺酰氯(SO2Cl2)。所用的反应装置如下图所示(部分夹持装置省略)。
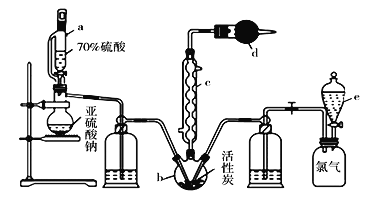
已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾。现拟用干燥的Cl2和SO2在活性炭催化下制取磺酰氯:Cl2(g)+SO2(g)![]() SO2Cl2(l),实验装置如图所示。
SO2Cl2(l),实验装置如图所示。
(1)化合物SO2Cl2中S元素的化合价为__________。
(2)仪器c的名称是_________,c中通入冷水的作用是___________
(3)由仪器c的使用可知SO2与Cl2的反应ΔH____0(填“<”或“>”),仪器d 的作用是____。
(4)采用上述部分装置获得干燥的原料气Cl2与SO2。装置e中所盛放的溶液为______(填溶液的名称)。
(5)SO2Cl2遇水能发生剧烈的水解反应,会产生白雾,则SO2Cl2发生水解反应的化学方程式为_______。
(6)反应结束后,将仪器b里的混合物分离的方法是______,
若反应中消耗氯气的体积为1.12L(已转化为标准状况,SO2足量),最后通过蒸馏得到纯净的磺酰氯5.13g,则磺酰氯的产率为___(保留三位有效数字)。
(7)为提高本实验中磺酰氯的产率,在实验操作中需要注意的事项有_____(填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈瓶发烫,可适当降温 ④加热三颈瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,R的最简单气态氢化物分子的空间结构为正四面体,X的+1价阳离子的电子层结构与氖原子相同。元素X和Z形成化合物G,G中X和Z元素的质量之比为 23:16.含Y元素的可溶性化合物E和含X的可溶性化合物F,在10mL 1.0molL﹣1 E 溶液中滴加1.0molL﹣1 F溶液,产生沉淀的物质的量(n)与F溶液体积(V)的关系如图所示。下列说法一定正确的是( )
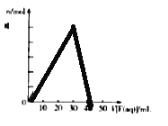
A. 原子半径:X>Y>R
B. 最高价氧化物对应水化物的酸性:Z>Y>R
C. X和Y的单质组成的混合物不能完全溶于水
D. 工业上,通过电解熔融氯化物制备Y的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2.0 L的密闭容器内,物质D在T ℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是

A. 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.0667 mol/(L·min)
B. 该反应的化学方程式为2D(s) 2A(g)+B(g),该反应的平衡常数表达式为K=c(A)2·c(B)
C. 已知:反应的H>0,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为____________。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反应的离子方程式为_____________________。
(2)电镀厂的废水中含有的CN-有剧毒,需要处理加以排放。处理含CN-废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为_____________。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子):
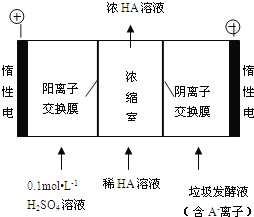
①阳极的电极反应式为________________________。
②简述浓缩室中得到浓乳酸的原理:________________________。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 g/L 乳酸溶液通电一段时间后,浓度上升为145 g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为________L(提示:乳酸的摩尔质量为90 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳排放是影响气候变化的重要因素之一。最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。下列有关说法中不正确的是( )
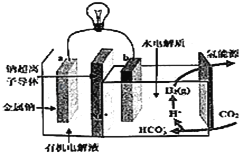
A. 系统工作时,化学能转变成电能
B. 系统工作时,电流由a极沿导线流向b极
C. 系统工作时,b极区可能会析出固体
D. 系统工作时,b极区的电极反应式为2CO2+2H2O+2e﹣=2HCO3﹣+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的氯气通入含Fe2+、I-、Br-的溶液,溶液中四种粒子的物质的量的变化如图所示。已知b=a+5,线段Ⅳ表示一种含氧酸,且线段I和Ⅳ表示的物质中含有相同的元素。下列说法错误的是

A. 线段I表示I-的变化情况
B. a点时消耗Cl2的体积为134.4 L
C. 原溶液中n(Fe2+):n(Br-) =2:3
D. 线段Ⅳ表明氧化性:C12>HIO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com