
分析 (1)H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解,说明B2-离子水解而HB-不水解,且HB-是弱酸,则Na2B溶液呈碱性;
(2)任何电解质溶液中都存在电荷守恒和物料守恒,据此分析解答;
(3)0.1mol•L-1NaHB溶液中HB-离子只有电离,溶液显酸性,据此回答.
解答 解:(1)H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解,说明B2-离子水解而HB-不水解,且HB-是弱酸,则Na2B溶液呈碱性,其水解方程式为:B2-+H2O?HB-+OH-,
故答案为:碱性;B2-+H2O?HB-+OH-;
(2)A.根据原子守恒应该为c(B2-)+c(HB- )+c(H2B)=0.1mol/L,H2B第一步完全电离,所以溶液中不存在H2B,则c(H2B)=0,故A错误;
B.H2B第一步完全电离,所以溶液中不存在H2B,溶液中存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(HB-),故B错误;
C.根据电荷守恒得c(Na+)+c(H+ )=c(OH- )+c(HB-)+2c(B2- ),故C正确;
D.根据物料守恒得c(Na+)=2c(B2- )+2c(HB- ),故D正确;
故选CD.
(3)0.1mol•L-1NaHB溶液中HB-离子只有电离,溶液显酸性.又因为水还电离出氢离子,则各种离子浓度由大到小的顺序是c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-).
故答案为:c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-).
点评 本题考查了离子浓度大小比较,注意该酸第一步完全电离、第二步部分电离,导致溶液中不存在H2B,为易错点,再结合守恒思想解答,题目难度中等,为易错题.


科目:高中化学 来源: 题型:解答题
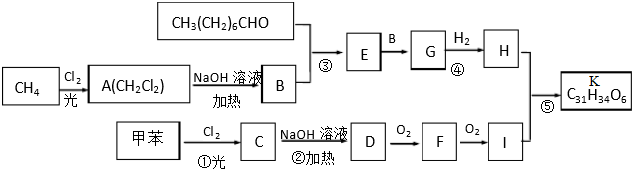
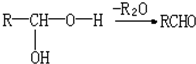
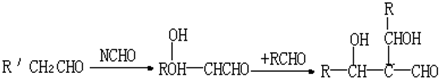
 .
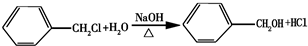
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+=Cu2++2H2O | |
| C. | NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+H2O+CO32- | |
| D. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、HCO3- | |
| B. | 酸性溶液中可能大量存在Na+、IO3?、SO42-、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、SO32-、S2- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2 Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3•H2O | |
| D. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在偏铝酸钠溶液中滴入少量的碳酸氢钠溶液HCO3-+AlO2-+H2O=Al(OH)3↓+CO2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+离子刚好完全沉淀2Al3++6OH-+3Ba2++3SO42-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 在碳酸氢镁溶液中逐滴加入澄清石灰水至过量Ca2++Mg2++2HCO3-+2OH-=CaCO3↓+2H2O+MgCO3↓ | |
| D. | 氢氧化铁固体溶于氢碘酸 Fe(OH)3+3H+=Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液呈碱性:NaHCO3═Na++HCO3- | |
| B. | 试管上的银镜用稀硝酸洗涤:Ag+2H+═2 Ag++H2↑ | |
| C. | 澄清苯酚钠溶液中通入二氧化碳气体,出现浑浊: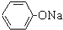 +H2O+CO2→ +H2O+CO2→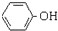 +NaHCO3 +NaHCO3 | |
| D. | 氨水与少量SO2反应:NH3?H2O+SO2═NH4++HSO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com