
【题目】合成气(CO和H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法:
① CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
② 2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是( )

A. E1表示2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g)的活化能
2CO(g)+4H2(g)的活化能
B. E2表示CH4(g)+H2O(g)![]() CO(g)+3H2(g)的活化能
CO(g)+3H2(g)的活化能
C. 该图示为反应②的反应过程与能量变化示意图
D. 一般情况下,加入催化剂,既能降低E1,也能降低E2,但不能改变E1与E2的差值
科目:高中化学 来源: 题型:
【题目】下列有关海水综合利用的说法正确的是( )
A.海水晒盐后的母液中,直接加入CCl4可萃取Br2单质
B.从海水制海盐主要是通过化学变化完成
C.电解氯化钠溶液可以制得钠单质和氯气
D.电解熔融的氯化镁可制备镁单质和氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是重要的合金元素,可制作镍铬、镍铝等合金,镍也常用作有机加氢的催化剂及制取配合物。
(1)写出基态Cr的简化电子排布式__________,Cr中共有__________种不同能级的电子。
(2)Ni(CO)n与Fe(CO)5同属金属羰基配合物,形成配合物时,每个CO提供一对电子与金属原子形成配位键,研究发现金属原子的价电子和CO提供的电子总和等于18。
①Ni、C、O的电负性由大到小的顺序为____________________。
② Ni(CO)n分子中n=__________。
③已知Ni2+和Fe2+的离子半径分别为69pm和78pm,根据岩浆晶出规则熔融的NiO和FeO岩浆在冷却过程中,NiO更容易先结晶,试解释其原因____________________。
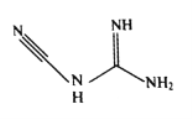
(3)检定镍、钴、铜钯等可用双氰胺,化学式C2H4N4,其结构简式如图所示。双氰胺分子中碳原子的杂化方式有__________,分子结构中键能最大的共价键是__________。
(4)镍的晶体结构、镍铝合金的晶胞如图所示。
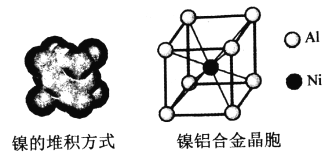
①镍晶体的堆积方式为__________。
②已知Al的第一、第二电离能分别为:l1=578kJ/mol,l2=1817kJ/mol,简述l2远大于l1的原因__________________________________________________。
③已知:镍铝合金密度为dg/cm3,NA代表阿伏伽德罗常数,则铝镍的核间距为__________ pm。(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中所含碘元素以碘离子(I-)的形式存在,经常食用海带可以防治甲状腺肿大。某同学设计实验从海带中提取碘,有如下操作:①滤液中滴加稀硫酸和双氧水;②在海带中加入少量酒精,使其燃烧为灰烬,在灰烬中加水搅拌;③加四氯化碳并振荡;④过滤;⑤分液;⑥蒸馏。下列说法不正确的是( )

A. 实验的合理操作顺序是②④①③⑤⑥
B. 步骤②、④中都需要用到玻璃棒
C. 步骤①中双氧水表现氧化性
D. 步骤⑥中所用装置如右图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓盐酸中H3AsO3与SnCl2反应:SnCl2+H3AsO3+HCl(浓)→As+SnCl4+M,则正确的组合是( )
①H3AsO3被还原;②还原性:Cl->As;③M为电解质;④SnCl4是氧化产物;⑤每生成7.5gAs,还原剂失去的电子为0.3mol
A. ①③④⑤ B. ①④⑤ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu、Fe、Se、Co、S、P等元素常用于化工材料的合成。请回答下列问题:
(1)Fe3+最外层电子排布式为___________,其核外共有_____种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是_______________________________________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为_________________(用元素符号表示),SeO2分子的空间构型为___________________。
(3)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为__________,每个P4S3分子中含孤电子对的数目为_______________。

(4)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为a cm,则该氧化物的密度为________g·cm-3。(设阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用NaHCO3和KHCO3组成的固体混合物进行实验,测得实验数据(盐酸的物质的量浓度相等)如表所示,下列说法不正确的是 ( )
盐酸/mL | 50 | 50 | 50 |
固体混合物质量/g | 9.2 | 15.7 | 27.6 |
标准状况下CO2体积/L | 2.24 | 3.36 | 3.36 |
A. 盐酸的物质的量浓度为3.0 mol·L-1 B. 根据表中数据能计算出混合物中NaHCO3的质量分数
C. 加入9.2g固体混合物时盐酸过量 D. 15.7g固体混合物恰好与盐酸完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(1)在第二周期的元素中,第一电离能介于B与N之间的元素有_________种。
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是____________________。
(3)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为______________。请写出一个与CO互为等电子体的离子:____________________。
(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH氧化成CH3COOH,试写出基态铬原子的价层电子排布式:_______________;CH3COOH分子中碳原子的杂化类型为_________________;乙醇和丙烷相对分子质量相近,但乙醇的熔、沸点比丙烷高很多,试解释其主要原因:____________________________________。
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为_______,NH3的VSEPR模型为_______。
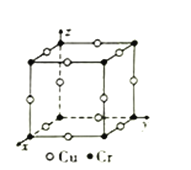
③图为Cu-Cr形成的一种合金的晶胞(假设晶体中原子之间彼此相切),单独属于该晶胞的Cu原子共有三个,其原子坐标可分别表示为:(![]() ,0,0)、(0,
,0,0)、(0, ![]() ,0)、_______;已知晶胞中Cr和Cu原子间的最近距离为
,0)、_______;已知晶胞中Cr和Cu原子间的最近距离为![]() apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com