
����Ŀ���Ե�ⷨ���������̲������������У����̺����ߴ�40%��50%����Ҫ�ɷ�ΪMnO2��ˮ����Һ�����������Pb2+��Sn2+���ؽ������ʡ������ղ��ø�����ά�ص�ľм�ڽ�Ũ����������£����͡�ˮ�⣬���������ǣ����������£����������������еĶ������̷�Ӧ���ɿ����Ե������̡�

�ش��������⣺
��1����ҵ�ϵ�������̵�ˮ��Һ���������̣������ĵ缫��ӦʽΪ__________��
��2����ƽ�������������з�����Ӧ�Ļ�ѧ����ʽ��C6 H12O6+_____MnO2+_____H2SO4=____MnSO4+____CO2��+____H2O��_____________________
��3����ȡ�����������������裬�������______���壨д��ѧʽ������Ⱦ������
��4�������յ�һ�ָ���Ʒ����Ҫ��ũҵ�������ϣ�д���仯ѧʽ��__________��
��5��ȡһ���������������ʵ��������õ�����ͼ����������������Ϊ_____mL������������������������ᵼ��________��(д��ѧʽ)������������

��6��ij��������MnO2����������Ϊ50.0%����174 g����������320 gŨ����(������������Ϊ36.5%)��ϼ��ȣ�������������ڱ�״����Ӧ����_____L����ȷ��0.1�������������е������ɷֲ����뷴Ӧ����
���𰸡� 4OH- -4e- =2H2O+O2�� 12��12��12��6��18 H2S��SO2 (NH4)2SO4 28 CaCO3 17. 9
����������1����ҵ�ϵ�������̵�ˮ��Һ���������̣������ĵ缫��ӦʽΪ4OH- -4e- =2H2O+O2����
��2�� �������������з�����Ӧ�Ļ�ѧ����ʽΪC6H12O6+12MnO2+12H2SO4=12MnSO4+6CO2��+18H2O��
��3����ȡ�����������������裬���������麟��ؽ���ʱ����Ũ�����������������ǿ�����ԣ�������立�Ӧ�������H2S��SO2�������Ⱦ������
��4�������յ�һ�ָ���Ʒ���������Ҫ��ũҵ�������ϣ��仯ѧʽΪ(NH4)2SO4��
��5����ͼ���֪�����������Ϊ28mLʱ���̵Ľ�������ߣ�������������������Ϊ28mL������������������������ᵼ�º��������CaCO3������������
��6��174 g�������ຬMnO2������Ϊ87g�������ʵ���Ϊ1mol��320 gŨ����(������������Ϊ36.5%)��HCl�����ʵ���Ϊ3.2mol���ɷ�Ӧ�Ļ�ѧ����ʽ��֪��Ũ����㣬����Ũ���ᷴӦһ��ʱ�����Ũ�ȼ�С��һ���̶ȺͲ��ٷ�Ӧ�ˣ�����������������ʵ���ҪС��![]() n(HCl)����С��0.8mol���ڱ�״�������������Ӧ����17. 9L��
n(HCl)����С��0.8mol���ڱ�״�������������Ӧ����17. 9L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ���ɫ����A����������Ͷ����ɫ��ҺB�з�������ת����ϵ����֪X������������ɵĻ�����壬����һ��Ϊ����ɫ���塣
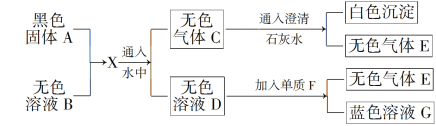
(1)�ɴ˿����ƶϣ�AΪ________��BΪ________��CΪ________��EΪ________��
(2)д��D��F��Ӧ�Ļ�ѧ����ʽ____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ�п�����ȡ�壬��Ҫ��ӦΪ��2Br��+Cl2=2Cl��+Br2 �� ����˵����ȷ���ǣ� ��
A.�����Ӿ���������
B.�����ǻ�ԭ��
C.�÷�Ӧ���ڸ��ֽⷴӦ
D.�����������Ա��嵥��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��R��T��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵ��ͼ��ʾ��Y��Z���γ�Z2Y��Z2Y2�����ӻ�����Rԭ�������������ǵ��Ӳ�����2����Z��T�γɵĻ�����Z2T���ƻ�ˮ�ĵ���ƽ�⡣����˵����ȷ����

A. ���⻯������ȶ��ԣ�R>Y
B. �����ӵİ뾶��Y>Z
C. ����������Ӧˮ��������ԣ�R>T
D. Y��T����ͬһ���塢��X����ͬһ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������滯ѧ���������ݣ��ж����з���������ʱ��ȶ�����(����)
��ѧ�� | H��H | H��F | H��Br | H��I |
����(kJ/mol) | 436 | 565 | 368 | 297 |
A.����B.������C.�廯��D.�⻯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������X������Y��0.32mol����10L�����ܱ������У�������Ӧx(g)+ Y(g) ![]() 2Z(g)AH<0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
2Z(g)AH<0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.24 | 0.22 | 0.20 | 0.20 |
����˵����ȷ������ ��
A. ��Ӧǰ2min ��ƽ������ v(Z)=4.0��10-3mol/(L��min)
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv������>v������
C. ���¶��´˷�Ӧ��ƽ�ⳣ��k=1.44
D. �����������䣬�ٳ���0.2molZ��ƽ��ʱX�����������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaH2����Ϊ�������������Ԫ�سʩ�1�ۣ��仯ѧ����ʽΪCaH2+2H2O�TCa��OH��2+2H2��������ˮ�ǣ� ��
A.��ԭ��
B.������
C.���ǻ�ԭ������������
D.�Ȳ����������ֲ��ǻ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������������ǵ�����������ʡ�
��1���γ������ԭ��֮һ�ɼ�ʾ��ͼ��
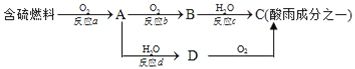
��ش��������⣺
�������pH_____�����������������=����5.6��
��D���ʵĻ�ѧʽΪ_____��
�۷�Ӧb�Ļ�ѧ����ʽΪ_____��
��2����һ�������°��������������������ת��Ϊ����Ⱦ�����ʣ�д�������Ͷ���������һ�������·�Ӧ���ɵ�����ˮ�Ļ�ѧ����ʽ��____________________����Ӧ����������____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com