
 实验室需要0.1mol/LNaOH溶液500mL,根据这种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液500mL,根据这种溶液的配制情况回答下列问题.分析 (1)根据配置一定物质的量浓度的溶液的步骤是称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析所需的仪器;
(2)A、使用容量瓶前要检查它是否漏水;
B、容量瓶用蒸馏水洗净后,再用待配液润洗,会导致溶质的量偏多;
C、容量瓶是用于配制一定浓度的定量仪器,不能够在容量瓶中溶解固体;
D、应该在烧杯中稀释浓溶液,不能够在容量瓶中直接稀释;
E、容量瓶摇匀时要防止瓶塞掉落打碎.
(3)根据质量m=CVM来计算;根据c=$\frac{n}{V}$并根据操作来判断n和V的变化来分析浓度的变化.
解答 解:(1)根据配置一定物质的量浓度的溶液的步骤是称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有量筒、托盘天平、烧杯、玻璃棒、500mL容量瓶和胶头滴管,故不需要的仪器为AC,还需要的仪器有烧杯、玻璃棒和500mL容量瓶,故答案为:AC;烧杯、玻璃棒和500mL容量瓶;
(2)A、使用容量瓶前要检查它是否漏水,防止在配制溶液过程中漏液,故A正确;
B、容量瓶用蒸馏水洗净后,再用待配液润洗,会导致溶质的量偏多,则所配溶液浓度偏大,故B错误;
C、容量瓶不能受热,故容量瓶中不能够溶解固体,应该在烧杯中溶解,故C错误;
D、容量瓶不能受热,故容量瓶不能用于稀释溶液,应该在烧杯中稀释,故D错误;
E、容量瓶摇匀时要防止瓶塞掉落打碎,故摇匀时食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转反复上下摇匀,故E正确.
故选BCD.
(3)所需的氢氧化钠的质量m=CVM=0.1mol/L×0.5L×40g/mol=2.0g;
若定容时仰视刻度线,则溶液体积偏大,则浓度偏小,即小于0.1mol/L.
故答案为:2.0;小于.
点评 本题考查一定物质的量浓度溶液的配制,注意仪器的选取方法和所需固体的计算,误差分析为易错点.


科目:高中化学 来源: 题型:填空题
 .乙烯的电子式是
.乙烯的电子式是 .将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是1:5
.将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是1:5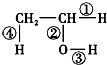 在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键.
在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中一定不含Ba2+ | |
| B. | 该溶液中一定含Na+ | |
| C. | 无色气体在标准状况下的体积约为2.24L | |
| D. | 若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,锥形瓶中盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,震荡,过一会儿可见小气球a鼓起.气体X和液体Y不可能是( )
如图所示,锥形瓶中盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,震荡,过一会儿可见小气球a鼓起.气体X和液体Y不可能是( )| A. | X是NH3,Y是水 | B. | X是CO2,Y是饱和NaHCO3浓溶液 | ||
| C. | X是SO2,Y是NaOH溶液 | D. | X是HCl,Y是NaNO3稀溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | H-F | H-Br | H-I |
| 键能(kJ/mol) | 436 | 565 | 368 | 297 |
| A. | 氢气 | B. | 氟化氢 | C. | 溴化氢 | D. | 碘化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和H2O2中的化学键类型完全相同 | |
| B. | N2的结构式为N-N | |
| C. | 一个D216O分子所含的中子数为10 | |
| D. | 二氧化碳 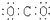 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
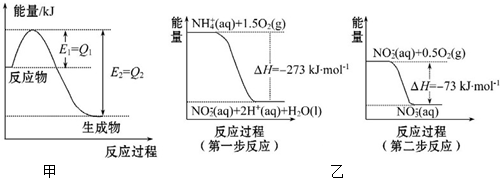
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com