
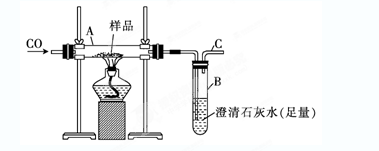
| A.热分解法 | B.热还原法 |
| C.电解法 | D.湿法冶金 |


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.Cu是还原剂,被腐蚀 | B.Fe3+是氧化剂 |
| C.该反应是置换反应 | D.该反应属于离子反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
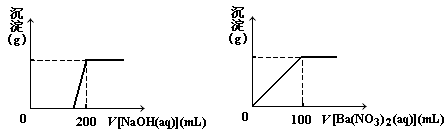
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.最后得到的溶液中不含有Fe3+ |
| B.残余固体可能为铁、铜混合物 |
| C.最后得到的溶液中只含Cu2+ |
| D.残余固体一定全部是铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
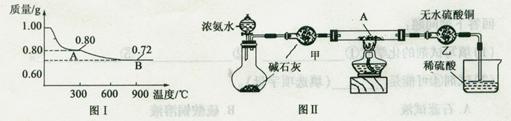
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
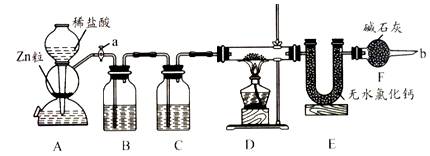
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5.52g | B.(m+6.8)g | C.(m+2.55)g | D.(m+12.0)g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com