
分析 溶液中的氢离子既包括硝酸电离的又包括硫酸电离的.所以n(H+)=3mol•L-1×0.01L×1+3mol•L-1×0.01L×2=0.09mol,n(NO3-)=3mol•L-1×0.01L=0.03mol,
n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,结合反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O解答该题.
解答 解:溶液中的氢离子既包括硝酸电离的又包括硫酸电离的.所以n(H+)=3mol•L-1×0.01L×1+3mol•L-1×0.01L×2=0.09mol,n(NO3-)=3mol•L-1×0.01L=0.03mol,
n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,则
3Cu+8H++2NO3-=3 Cu2++2NO↑+4H2O
3 8 2 3 2
0.03 0.09 0.03
可知Cu完全反应,H+和NO3-过量,则
(1)由反应的离子方程式可知n(NO)=$\frac{0.03mol×2}{3}$=0.02mol,V(NO)=0.02mol×22.4L/mol=0.448L,
答:产生的气体在标准状况下的体积是0.448L;
(2)0.03molCu完全反应,则生成0.03molCu2+,消耗n(H+)=$\frac{0.03mol×8}{3}$=0.08mol,剩余n(H+)=0.09mol-0.08mol=0.01mol,消耗n(NO3-)=n(NO)=0.02mol,则剩余n(NO3-)=0.03mol-0.02mol=0.01mol,
所以反应后溶液中c(Cu2+)=$\frac{0.03mol}{0.01L}$=3mol/L,c(H+)=$\frac{0.01mol}{0.01L}$=1mol/L,c(NO3-)=$\frac{0.01mol}{0.01L}$=1mol/L,
由于SO42-没有参加反应,反应后的浓度仍为3mol/L,
答:反应后溶液中各溶质离子物质的量浓度分别是Cu2+:3mol/L,H+:1mol/L,NO3-:1mol/L,SO42-:3mol/L.
点评 本题考查化学方程式的计算,为高考高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关反应方程式的书写,根据方程式计算该题,难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 C7H16的同分异构体中具有“手性碳原子”的有2种,写出其中一种的名称3-甲基己烷(或2,3-二甲基戊烷).
C7H16的同分异构体中具有“手性碳原子”的有2种,写出其中一种的名称3-甲基己烷(或2,3-二甲基戊烷).

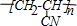 ,反应所属类型分别为加成反应、加聚反应.
,反应所属类型分别为加成反应、加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 两极材料 | Zn片、石墨 | Cu片、Ag片 | Zn片、Cu片 | Fe片、Cu片 |
| 插入溶液 | 硫酸溶液 | 硝酸银溶液 | 蔗糖溶液 | 稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是钠原子 | ||
| C. | 单质的熔点逐渐增大 | D. | 原子半径随核电荷数的增大而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
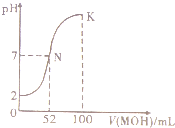 常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | 在K点,c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | K点对应的溶液中,有c( MOH)+c( M+)=0.02 mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2b kJ/mol | |
| B. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-4b kJ/mol | |
| C. | C2H2(g)+O2(g)═2CO2(g)+H2O(l)△H=+2b kJ/mol | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-$\frac{b}{a}$kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
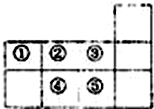
| A. | 元素①于第二周期第IVA族 | B. | 气态氢化物的稳定性:④>② | ||
| C. | 单质⑤遇足量元素①的氢化物有白烟 | D. | 元素的最高正化合价:③=⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com