
已知反应A2(g) + 2B2(g) 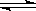 2AB2(g) △H<0,下列说法正确的是( )
2AB2(g) △H<0,下列说法正确的是( )
A.升高温度,正反应速率增加,逆反应速率减小
B.增大压强能使正、逆反应速率都增大,但有利于平衡正向移动
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
高锰酸钾(KMnO4)和过氧化氢(H2O2)是两种典型的氧化剂。
(1)H2O2的结构式为________________。
(2)下列物质中能使酸性KMnO4溶液褪色的是________(填选项字母)。
A.臭碱(Na2S) B.小苏打(NaHCO3)
C.水玻璃(Na2SiO3) D.酒精(C2H5OH)
(3)高锰酸钾、双氧水、活性炭常用于饮用水的处理,但三者联合作用时必须有先后顺序。①在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-―→2H++O2↑
还原反应:MnO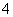 +5e-+8H+―→Mn2++4H2O
+5e-+8H+―→Mn2++4H2O
写出该氧化还原反应的离子方程式_____________________________。
②在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,否则会发生反应:KMnO4+C+H2O―→MnO2+X+K2CO3(未配平),其中X的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
 在5L的密闭容器中进行下述反应4NH3(g)+5O2(g)
在5L的密闭容器中进行下述反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g) 30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是( )
4NO(g)+6H2O(g) 30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是( )
A.V(O2 )=0.01mol·L-1·s-1 B. V(NO )=0.08mol·L-1·s-1
C. V(H2O)=0.01mol·L-1·s-1 D. V(NH3)=0.002mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知C(石墨,s) = C(金刚石,s) △H>0,
P(白磷,s) = P(红磷,s) △H<0。根据上述信息推论正确的是( )
A.前者为放热反应 B.红磷的能量比白磷低
C.红磷比金刚石稳定 D.上述变化都为物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应M + N = P,如果温度每升高10℃,化学反应速率增加到3倍,在20℃时完成该反应的30%需要81 min,若将温度升高到40℃,完成该反应的30%需要时间为( )
A.9 min B.27 min C.13.5 min D.3 min
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列离子方程式正确的是( )
下列离子方程式正确的是( )
 A.澄清石灰水与盐酸反应:H+ + OH- = H2O
A.澄清石灰水与盐酸反应:H+ + OH- = H2O
 B.把金属铁放入稀H2SO4中反应:2Fe + 6H+ = 2Fe3+ + 3H2 ↑
B.把金属铁放入稀H2SO4中反应:2Fe + 6H+ = 2Fe3+ + 3H2 ↑
 C.
C.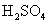 与
与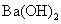 溶液反应:Ba2+ + H+ + OH-+ SO42—= BaSO4 ↓+ H2O
溶液反应:Ba2+ + H+ + OH-+ SO42—= BaSO4 ↓+ H2O
 D.
D.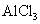 溶液中加入过量的浓氨水:Al3+ + 4NH3·H2O = AlO2-+ 4NH4+ + 2H2O
溶液中加入过量的浓氨水:Al3+ + 4NH3·H2O = AlO2-+ 4NH4+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)对于下列反应:2SO2(g) + O2(g) 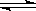 2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。
2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。
(2)下图表示在密闭容器中反应:2SO2+O2 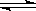 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是 ;b~c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处。
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是 ;b~c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处。
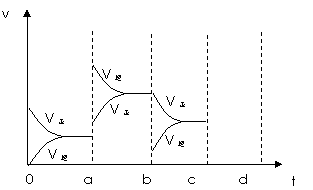 |
(3)以上反应达平衡后,
若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应正向为 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均相对分子质量
比原平衡时 (填“增大”、“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中于一定条件下进行下列反应:2SO2 + O2 2SO3当到达平衡时通入18O2,再次平衡时,18O存在于( )
2SO3当到达平衡时通入18O2,再次平衡时,18O存在于( )
A、SO2 、O2 B、SO2 、SO3
C、SO2 、O2 、SO3 D、O2 、SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,合成氨气反应达到平衡时,测得混合气体中氨气的体积分数为20.0% ,与反应前的体积相比,反应后体积缩小的百分率是
A.16.7% B.20.0% C.80.0% D.83.3%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com