
分析 发生反应:Fe+CuSO4═FeSO4+Cu,利用差量法来计算参加反应的CuSO4的物质的量,进而计算反应后溶液中CuSO4的物质的量浓度.
解答 解:设参加反应的CuSO4的物质的量为xmol,则:
Fe+CuSO4 ═FeSO4 +Cu 质量增重△m
1mol 64g-56g=8g
xmol 10.6g-10g=0.6g
所以1mol:xmol=8g:0.6g
解得x=0.075mol
反应后剩余硫酸铜:0.2L×0.2mol/L-0.075mol=0.035mol,其浓度为:$\frac{0.035mol}{0.2L}$=0.175mol/L,
答:反应后溶液后溶液中硫酸铜物质的量浓度为0.175mol/L.
点评 本题考查化学反应方程式的计算,难度不大,注意对差量法的理解应用.


科目:高中化学 来源: 题型:选择题
| A. | 铁制品在潮湿空气中更易锈蚀 | |
| B. | 二氧化硅常用于制造光导纤维 | |
| C. | 实验室中经过滤可得到纳米碳酸钙固体 | |
| D. | 聚乙烯可作食品包装材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaOH+H2SO4═Na2SO4+2H2O | B. | 2SO2+O2+2H2O═2H2SO4 | ||
| C. | Cu+2H2SO4$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | D. | C+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$2SO2↑+CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
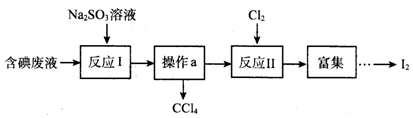
| A. | 操作a的名称为蒸馏 | |
| B. | 反应I、II中碘元素均被氧化 | |
| C. | 还原性强弱顺序:SO32->I->Cl- | |
| D. | 若反应I消耗25.2g Na2SO3,则反应II消耗标准状况下氯气的体积为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com