
 ⑥
⑥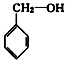 ⑦
⑦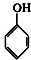
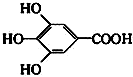
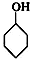
分析 (1)分子中含有跟链烃基或苯环侧链上的碳结合的羟基的化合物叫做醇;
(2)根据反应物及化合价的变化判断;
(3)由信息可知,铁盐与没食子酸的显色反应,并由此发现了蓝黑墨水,结合苯酚显色反应分析.
解答 解:(1)分子中含有跟链烃基或苯环侧链上的碳结合的羟基的化合物叫做醇,苯环上的氢被羟基取代而生成的化合物属酚类;①②③④⑤⑥属于醇,⑦属于酚,
故答案为:①②③④⑤⑥;
(2)由题意知,被检测的物质是乙醇;该反应2CrO3 (红色)+3C2H5OH+3H2SO4=Cr2(SO4)3(绿色)+3CH3CHO+6H2O中,元素的化合价变化如下:CrO3→Cr2(SO4)3,Cr元素由+6价→+3价,得电子化合价降低,CrO3是氧化剂;C2H5OH→CH3CHO,C元素由-2价→-1价,失电子化合价升高,乙醇是还原剂,
故答案为:C2H5OH;CrO3;C2H5OH;
(3)由信息可知,铁盐与没食子酸的显色反应,并由此发现了蓝黑墨水,由苯酚显色反应可知,利用了酚的性质,故答案为:B.
点评 本题考查醇类的定义、乙醇的检验和氧化剂还原剂等,难度不大,注意苯环上的氢被羟基取代而生成的化合物不属醇类而属酚类.


科目:高中化学 来源: 题型:选择题
| A. | Zn与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | 金属铜与稀盐酸反应:Cu+2H+═Cu2++H2↑ | |
| C. | Ca(OH)2溶液与Na2CO3溶液反应:Ca2++CO${\;}_{3}^{2-}$═CaCO3↓ | |
| D. | 氧化铁与稀盐酸反应:Fe2O3+6H+═2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 轮船上镶嵌的锌块,是利用了外加电流的阴极保护法 | |
| B. | 给Fe上镀一层Ag,应将Fe与电源的负极相连,Ag与电源的正极相连,电解质为AgNO3溶液 | |
| C. | 用惰性电极电解Na2SO4溶液,若有1mol电子转移,则生成11.2LH2 | |
| D. | 电解精炼铜时,将粗铜作电解池的阴极,纯铜作电解池的阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应时不一定都伴随着能量变化 | |
| B. | 一个化学反应中,当反应物总能量大于反应产物总能量时,反应放热,△H>0 | |
| C. | 在加热条件下发生的反应均为吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | abc | B. | ade | C. | dce | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:| 化合物 名称 | 密度(g/mL ) | 熔 点(℃) | 沸 点(℃) | 水中溶解性 |
| 正丁醇 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注:正丁醚微溶于饱和氯化钙溶液. | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com