
 A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )
A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )| A. | C的氯化物与水反应,可生成白色烟雾 | |
| B. | A的氧化物对应的水化物一定为强酸 | |
| C. | D的最高价氧化物对应的水化物能和D的氢化物发生反应生成盐 | |
| D. | 向含B元素的盐溶液中滴加碳酸氢钠溶液,可能不出现白色沉淀 |
分析 A、B、C、D四种短周期元素中只有一种金属元素,根据元素在周期表中的位置知,只有B为金属元素,则B为Al元素,C为Si元素,A为N元素,D为S元素,
A.SiCl4与水反应生成HCl;
B.N元素的氧化物的水化物有多种;
C.D为S元素,其氢化物为H2S,最高价氧化物对应的水化物为硫酸;
D.铝盐与碳酸氢钠会发生双水解的反应.
解答 解:A、B、C、D四种短周期元素中只有一种金属元素,根据元素在周期表中的位置知,只有B为金属元素,则B为Al元素,C为Si元素,A为N元素,D为S元素,
A.C的氯化物为SiCl4,SiCl4与水反应生成HCl,可以生成白色烟雾,故A正确;
B.N元素的氧化物的水化物有多种,其中HNO2为弱酸,故B错误;
C.D为S元素,其氢化物为H2S,最高价氧化物对应的水化物为硫酸,硫化氢与硫酸反应不能生成盐,故C错误;
D.铝盐与碳酸氢钠会发生双水解的反应,生成二氧化碳和氢氧化铝沉淀,即有白色沉淀生成,故D错误.
故选A.
点评 本题考查了元素周期表和元素周期律的综合应用,根据元素位置确定元素,再结合物质性质、元素周期律解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
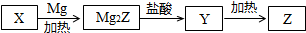
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1803 年道尔顿提出的“元素的原子以其原子质量为特征” | |
| B. | 1808 年盖•吕萨克提出的“同温同压下,相同体积的不同气体含有相同数目的原子” | |
| C. | 1811 年贝来里乌斯提出的“不同原子显不同电性,因而产生吸引力形成化合物“ | |
| D. | 1887 年阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )
直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )| A. | 电子经外电路自b极流向a极 | |
| B. | b极的电极半反应为O2+4e-+4H+=2H2O | |
| C. | 质子交换膜中的H+流向a极 | |
| D. | 以此电池供电,电解CuSO4溶液,理论上每生成0.1molCu最少需要氧气1.12L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
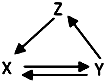 如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )| X | Y | Z | |
| ① | SiO2 | H2SiO3 | Na2SiO3 |
| ② | CH3CH2OH | CH3CHO | CH2=CH2 |
| ③ | AlCl3 | Al(OH)3 | Al2O3 |
| ④ | NO | NO2 | HNO3 |
| ⑤ | FeCl2 | Fe | FeCl3 |
| A. | ③④⑤ | B. | ②③④ | C. | ④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中的能量变化如图所示: | |
| B. | CO(g)+2H2 (g)═CH3OH(g)△H<-90.5kJ•mol-1 | |
| C. | 2CH4 (g)+3O2 (g)═2CO(g)+4H2O(g)△H<-71.0kJ•mol-1 | |
| D. | 2CH4 (g)+$\frac{1}{2}$O2 (g)═CH3OH( l))△H=-126.0kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、OH-、Ba2+、NO3- | B. | Al3+、AlO2-、HCO3-、Na+ | ||
| C. | Na+、Fe3+、SO42-、I- | D. | Fe3+、SCN-、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com