
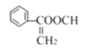
【题目】肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体。合成肉桂酸甲酯的工业流程如下图所示:
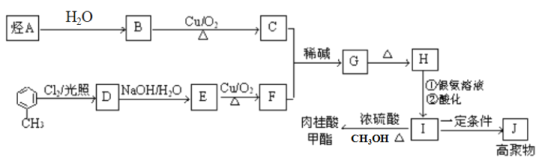
已知:I. 烃A在标准状况下的密度为1.25 g/L。
II.醛与醛能发生反应,原理如下:
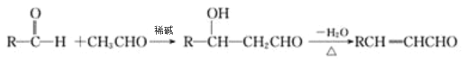
请回答:
(1)化合物H中的官能团为_____________________。
(2)肉桂酸甲酯的结构简式为_________________,J的结构简式为____________。
(3)G→H的反应类型为________。
(4)写出反应B→C的化学方程式___________________________。
(5)符合下列条件的I的同分异构体共有5种。写出另两种同分异构体的结构简式:
A.能发生水解反应
B.与银氨溶液作用出现光亮的银镜
C.能与溴发生加成
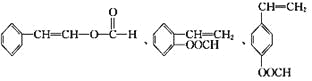 、_________、__________
、_________、__________
【答案】碳碳双键和醛基 ![]()
 消去反应 2CH3CH2OH + O2
消去反应 2CH3CH2OH + O2![]() 2CH3CHO + 2H2O
2CH3CHO + 2H2O ![]()
【解析】
烃A在标准状况下的密度为1.25g/L,则Mr(A)=1.25×22.4=28,故A为乙烯,与水发生加成反应生成B为乙醇;B发生氧化反应生成C为CH3CHO;乙醛与F发生信息中反应得到G,故F中含有醛基,结合转化关系可知,甲苯与氯气发生甲基上的取代反应生成D为![]() ,D发生水解反应生成E为
,D发生水解反应生成E为![]() ,E发生氧化反应生成F为
,E发生氧化反应生成F为![]() ,结合信息可知,G为
,结合信息可知,G为 ,H为
,H为![]() ,I为
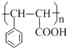
,I为![]() ,I发生加聚反应生成高聚物J为
,I发生加聚反应生成高聚物J为 ,I与甲醇反应发生酯化反应生成肉桂酸甲酯为
,I与甲醇反应发生酯化反应生成肉桂酸甲酯为![]() 。
。
(1)由上述分析可知,化合物H的结构简式为![]() ,含有官能团有:醛基、碳碳双键;
,含有官能团有:醛基、碳碳双键;
(2)由上述分析可知,肉桂酸甲酯的结构简式为![]() ,J的结构简式为
,J的结构简式为 ;
;
(3)G→H为 发生消去反应生成
发生消去反应生成![]() ,故答案为消去反应;
,故答案为消去反应;
(4)B→C的反应为乙醇的催化氧化生成CH3CHO,方程式为:2CH3CH2OH + O2![]() 2CH3CHO + 2H2O;
2CH3CHO + 2H2O;
(5)符合下列条件的I(![]() )的同分异构体共有5种:A.能发生水解反应,含有酯基,B.与银氨溶液作用出现光亮的银镜,结合A可知,含有甲酸形成的酯基,C.能与溴发生加成反应,含有碳碳双键,除
)的同分异构体共有5种:A.能发生水解反应,含有酯基,B.与银氨溶液作用出现光亮的银镜,结合A可知,含有甲酸形成的酯基,C.能与溴发生加成反应,含有碳碳双键,除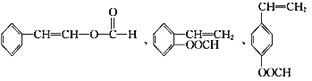 外,还有:
外,还有:![]() 、
、 。
。
【点晴】
本题考查有机物的推断,确定A为乙烯后顺推确定C为乙醛,结合反应信息判断F的含有的官能团,再结合反应条件进行推断,较好的合成学生分析推理能力,需要学生熟练掌握官能团的性质与转化。有机物的合成通过有机反应来实现,各类有机物的结构和性质,就是有机合成的基础。一种有机物的性质,往往是另一种有机物的制备方法,尽管有机物数量庞大,但是各类有机物之间一般存在着确定的相互转化的衍生关系,理解和掌握这种关系,可以为寻找有机物合成的合理途径、正确地进行有机物的制备提供科学的依据。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】在一体积为1 L的密闭容器中,通入一定量的CO和H2O,在850 ℃ 发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。CO和H2O浓度变化如图:
CO2(g)+H2(g) ΔH<0。CO和H2O浓度变化如图:

(1)0~4 min的平均反应速率v(CO)=__________________mol·(L·min)-1。
(2)850 ℃时,平衡常数K=___________________。
(3)850 ℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为___________。
(4)能判断该反应达到化学平衡状态的依据是________(填选项序号)。
a.v正(H2)=v逆(H2O) b.c(CO2)=c(CO)
c.容器中气体密度不变 d.1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号,其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
下列说法正确的是( )
A.R原子的核外电子排布图为![]()
B.Y2-与Na+的半径大小关系为Y2->Na+
C.X的第一电离能小于Y的第一电离能
D.表中电负性最大的元素为W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 现有一组物质的熔点(℃)数据,据此回答下列问题:
HF:-83 | HCl:-115 | HBr:-89 | HI:-51 |
(1)HF熔点反常是由于______________。这组物质中共价键的键能最大的是_____。
II.按要求回答下列问题。
(2)CS2气化时克服的粒子间作用是__________,1mol CS2中含有___mol σ键,含有___mol π键。
(3)HCHO分子中C原子轨道的杂化类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g) ![]() 3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
A.4molA+2molB B.3molC+1molB+1molD+1molA
C.2molA+1molB+1molD D.1molA+0.5molB + 1.5molC+0.5molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol SO2和1 mol O2通入体积不变的密闭容器中,在一定条件下发生反应2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
A. 0.3 mol B. 0.15 mol
C. 小于0.15 mol D. 大于0.15 mol,小于0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为前四周期元素.A元素的原子价电子排布为![]() ,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P轨道中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P轨道中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
![]() 当
当![]() 时,
时,![]() 属于 ______ 分子
属于 ______ 分子![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() .
.
![]() 当
当![]() 时,A与B形成的晶体属于 ______ 晶体.
时,A与B形成的晶体属于 ______ 晶体.
![]() 若A元素的原子价电子排布为
若A元素的原子价电子排布为![]() ,A、C、D三种元素的第一电离能由大到小的顺序是 ______
,A、C、D三种元素的第一电离能由大到小的顺序是 ______ ![]() 用元素符号表示
用元素符号表示![]() 。
。
![]() 已知某红紫色配合物的组成为
已知某红紫色配合物的组成为![]() 该配合物中的中心离子钴离子在基态时核外电子排布式为 ______ ,又已知中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质化学式是 ______ 。
该配合物中的中心离子钴离子在基态时核外电子排布式为 ______ ,又已知中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质化学式是 ______ 。
![]() 金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 ______ 。
金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 ______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某第三周期金属元素R的部分电离能情况如图Ⅰ所示,则R元素位于正确表第____族,其基态原子第二能层电子排布图为_____________________。
图Ⅱ中 A、B、C、D是四种不同主族元素的气态氢化物,其中A比B分子沸点高的可能原因是_________。

图Ⅱ中C物质能与第二周期中的另一种元素的氢化物通过配位键相互作用得到化合物X,X是一种储氢材料,且X是乙烷的等电子体,加热X会缓慢释放H2同时生成化合物Y,Y又是乙烯的等电子体,则化合物C的VSEPR模型是__________,X的结构式为__________(标明配位键)。
(2)已知Ti3+可形成配位数为6的配合物。
现有钛的两种配合物,组成皆为TiCl3·6H2O,一种为紫色,另一种为绿色,现取等质量的两种物质的样品配成待测溶液,分别往待测溶液中滴入AgNO3溶液充分反应,产生白色沉淀;测得绿色物质得到的沉淀质量是紫色物质得到的沉淀质量的2/3。则原绿色配合物的化学式为_____________,原紫色配合物的化学式为_____________。
(3)由某原子构成的晶胞,己知晶胞密度为ρg/cm3,边长为anm。若该原子半径为(![]() )anm,则该晶胞类型为______________;该原子的摩尔质量表达式为______________。
)anm,则该晶胞类型为______________;该原子的摩尔质量表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH== - Q1 ;
2H2(g)+O2(g) →2H2O(g) ΔH== - Q2;
H2O(g) →H2O(l) ΔH== - Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为
A.4Q1+0.5Q2B.4Q1+Q2+10Q3C.4Q1+2Q2D.4Q1+0.5Q2+9Q3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com