
【题目】下列图示与对应的叙述不相符合的是

A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】下列各种仪器:①漏斗②容量瓶③表面皿④分液漏斗⑤天平⑥量筒⑦胶头滴管⑧蒸馏烧瓶。常用于物质分离的是( )
A.①③⑦B.②⑥⑦
C.①④⑧D.④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液的说法正确的是( )
A. 将Na2CO3溶液用水稀释后,pH变大,Kw不变
B. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
C. pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH)
D. 分别用pH=2和pH=3 的 CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va=Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应: COS(g)+ H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol
H2S(g)+CO2(g) △H=-34kJ/mol
氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
己知: 2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol
写出表示CO燃烧热的热化学方程式:_______________。
(2)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11;草酸H2C2O4,K1=5.9×10-2,K2=6.4×10-5; 0.1mol/LNa2CO3溶液的pH_____0.1mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)。若将等分浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是___________。(选填编号)
A.c(H+)>c(HC2O4-)> (HCO3-)>c (CO32-)
B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
(3)已知:①难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10;②25℃时2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体长变化),得到c(HF)、c(F-) 与溶液pH 的变化关系,如图所示:
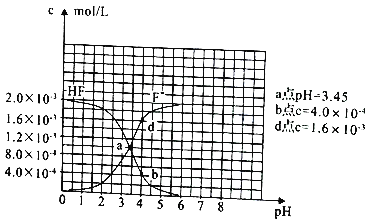
请根据信息回答下列问题:
①25℃时,HF电离平衡常数的数值Ka≈_______。
②4.0×10-3mol/LHF溶液与4.0×10-4mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中富含碘元素,有人设计如下步骤来提取碘:①通足量氯气;②将海带烧成灰,向灰中加水搅拌;③加入CCl4振荡;④过滤;⑤用分液漏斗分液。合理的操作顺序为
A. ②①④③⑤ B. ②④①③⑤ C. ①③⑤②④ D. ③①②⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是( )
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | 品红溶液中通入足量SO2气体 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 红色褪去 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是________(填元素符号),其中C原子的核外电子排布式为__________________。
(2)单质A有两种同素异形体,其中沸点高的是______(填分子式),原因是__________________________________________;A和B的氢化物所属的晶体类型分别为________和________。
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为______________,中心原子的杂化轨道类型为________。
(4)化合物D2A的立体构型为________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_______________________________________________。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566 nm,F的化学式为________;晶体F的密度(g·cm-3 )________________________________。(列出表达式)
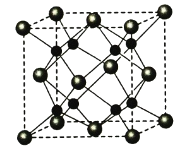
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol乙烯与氯化氢发生加成反应后,再与氯气发生取代反应,整个过程中最多消耗氯气的量
A. 3molB. 4molC. 5molD. 6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类全部正确的是()
A. CO——酸性氧化物CaO——碱性氧化物
B. 冰水混合物——混合物胆矾——纯净物
C. 烧碱——碱硫化氢——酸
D. NaHSO4——一元酸 BaSO4——强电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com