
已知:反应①Fes)+CO2g)FeOs)+COg)的平衡常数为K1;反应②Fes)+H2Og)FeOs)+H2g)的平衡常数为K2,不同温度下K1、K2的值如表中所示:
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1 173 K | 2.15 | 1.67 |
请回答下列问题:
1)从表中数据可以推断:反应①是________填“吸”或“放”)热反应。
2)现有反应CO2g)+H2g)COg)+H2Og),写出该反应的平衡常数K3的数学表达式:________。
3)根据反应①与②,可推导出K1、K2与K3之间的关系式。据此关系式及表中数据,也能推断出反应③是吸热反应还是放热反应。欲使反应③在一定条件下建立的平衡向正反应方向移动,可采用的措施有________填序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
向盛有5 mL 0.005 mol·L-1 FeCl3溶液的试管中加入5 mL 0.01 mol·L-1 KSCN溶液,充分混匀,溶液颜色深浅不再变化后建立化学平衡FeCl3+3KSCN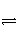
 Fe(SCN)3+3KCl。下列叙述中,不正确的是( )
Fe(SCN)3+3KCl。下列叙述中,不正确的是( )
A.加水至溶液的体积加倍,溶液红色变浅,但化学平衡不移动
B.再滴加少量0.1 mol·L-1 KCl溶液,溶液红色变浅,化学平衡左移
C.再滴加少量0.1 mol·L-1 NaOH溶液,会有红褐色沉淀产生,上部溶液红色变浅,化学平衡左移
D.再滴加少量0.1 mol·L-1 FeCl3溶液,溶液红色变深,化学平衡右移
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数。下列说法正确的是( )
A.标准状况下,11.2L乙烯含有的极性共价键数为NA
B.常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA
C.16.9gBaO2固体中阴、阳离子总数为0.2NA
D.含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10-12,取适量的MgCl2溶液,
加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
A.所得溶液中的c (H+)=10-13mol/L
B.所得溶液中由水电离产生的c (OH-)=10-13 mol/L
C.所加的烧碱溶液的pH=13.0
D.所得溶液中的c (Mg2+)=5.6×10-10 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。
2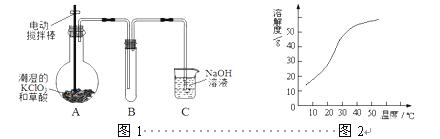
(1)A装置电动搅拌棒的作用是 。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。已知(1)NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;(2)NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知2 Na2S2O3 + I2 =Na2S4O6 + 2NaI)。
①配制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
②滴定过程中进行三次平行测定的原因是 。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 。(填“偏高”、“偏低”或“不变” )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是双选) )。
A.已知在T ℃时,反应2Ag)+Bg)3Cg) ΔH>0的正反应速率表示为v,若降低温度,正反应速率减小,逆反应速率增大
B.在恒容容器中发生反应N2g)+3H2g)2NH3g),若往容器中充入He,正逆反应的速率均不变
C.当一定量的锌粉和4 mol·L-1的过量盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向容器中加入一些水或硝酸钠溶液
D.对任何一个化学反应,温度发生变化,化学反应速率一定发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中 T 所处的周期序数与族序数相等。下列判断不正确的是 )。
| R | |||
| T | Q | W |
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
利用图中装置,可以模拟铁的电化学防护。下列有关说法正确的是(双选)( )。

A.若X为碳棒,开关K置于M处,达到防护铁闸门的目的
B.若X为碳棒,开关K置于N处比未闭合时铁闸门腐蚀得更快
C.若X为碳棒,开关K置于N处,一段时间后,该海水中滴加K3[Fe(CN)6]溶液无明显现象
D.若X为锌棒,开关K置于M处,铁闸门被保护
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应基本概念的相互关系
对于3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(1)Cu在反应中________电子,发生________反应,是________剂。
(2)HNO3在反应中________电子,被________,是________剂。
(3)该反应的氧化产物是________________,还原产物是________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com