

 .
. 分析 (1)烧瓶的作用就是加热液体或者对液体进行蒸馏,为了防止向试管中通入水蒸气使试管骤冷,引起水的倒流而加了装置C;
(2)为了方便加入稀盐酸使用了长颈漏斗,由于盐酸具有挥发性,所以在生成氢气的同时也会带出一部分水蒸气和氯化氢.需要碱性的固体干燥剂;
(3)反应需要高温和水蒸气,故装置I中A和B都需要加热.
(4)根据A中发生反应 ,此反应转移8mol电子来分析.
,此反应转移8mol电子来分析.
(5)铁与水蒸气在高温条件下生成四氧化三铁和氢气,据此写出化学方程式.
解答 解:(1)根据题干中所提供的物质可以推断出第一步实验中除了生成四氧化三铁外还会生成氢气,发生的反应为铁在高温和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O $\frac{\underline{\;高温\;}}{\;}$4H2+Fe3O4;试管A是铁与水蒸气反应的装置,故在A中装的应该是普通铁粉,在反应过程中 要生成氢气,所以D是用来收集氢气的,烧瓶的作用就是加热液体或者对液体进行蒸馏,所以这里蒸馏瓶所起的作用就是产生水蒸气,为了防止向试管中通入水蒸气使试管骤冷,引起水的倒流从而在试管和收集气体的试管中间加上了广口瓶,保证实验安全;A中是铁和水蒸气的反应;B中为产生水蒸气的装置,C为安全瓶防止倒吸的作用,D中收集的是氢气,
故答案为:普通铁粉(或铁粉);产生水蒸气;防止水倒吸(或用作安全瓶);
(2)装置I是用来制取氢气的装置,所以装置H是用来添加6mol/L盐酸的,F中发生反应:Fe3O4+4H2 $\frac{\underline{\;高温\;}}{\;}$3Fe+4H2O;由于使用的是稀盐酸来制取氢气,所以在产生氢气的同时可能带出部分水蒸气和氯化氢气体,故在U型管中加入固体来干燥气体,吸收氯化氢和水蒸气,故答案为:6mol/L的稀盐酸; 除去H2中混有的HCl和水蒸气;
(3)反应是在高温的条件下反应的,所以A装置要加热,同时反应需要水蒸气的参加,故B也需要加热,故答案为:AB;
(4)根据A中发生反应 ,此反应转移8mol电子,生成4mol氢气,故当转移4mol电子时,生成2mol氢气,在标况下体积为44.8L,故答案为:44.8L;
,此反应转移8mol电子,生成4mol氢气,故当转移4mol电子时,生成2mol氢气,在标况下体积为44.8L,故答案为:44.8L;
(5)铁与水蒸气在高温条件下生成四氧化三铁和氢气,据此写出化学方程式: ,故答案为:
,故答案为: .
.
点评 本题考查了铁及其化合物性质的应用,主要是铁和水反应,氢气还原铁的氧化物反应,实验设计的装置判断和反应位置判断,我们在制取氢气时通常用的是稀硫酸,但是本题要求我们必须使用稀盐酸,故氢氧化钠的作用起了一箭双雕的作用,这点是我们做题时易错的地方,要多加注意,从这里可以看出,我们在做题时要克服思维定势,仔细审题以保证答题的准确性.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向含有H+,Al3+,Mg2+的溶液中,逐渐加入NaOH溶液 | |
| B. |  向Al2(SO4)3溶液中加入Ba(OH)2溶液 | |
| C. |  物质的量相等的镁和铝分别与等浓度、等体积的过量稀硫酸反应 | |
| D. |  向AlCl3溶液中加氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
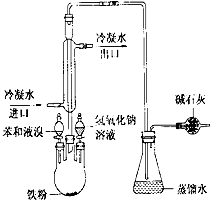 如图是实验室制取溴苯的装置图
如图是实验室制取溴苯的装置图查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | 2CH2CH2OH$→_{△}^{Cu}$2CH3CHO+H2O | ||
| C. | CH4+Cl2$\stackrel{光}{→}$CH2Cl+HCl | D. | CH2═CH2+H2$\stackrel{催化剂}{→}$CH3-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com